近日,我校免疫化学研究所(SIAIS)特聘教授、创始所长Richard Lerner课题组在国际一流学术期刊《Angewandte Chemie-International Edition》(2015年影响因子11.261)上发表了题为“Autocrine-Based Selection of Drugs that Target Ion Channels from Combinatorial Venom Peptide Libraries”的封面文章,介绍以离子通道作为靶点的动物毒素多肽药物筛选新策略。SIAIS访问教授、Scripps研究所高级科学家张宏恺和SIAIS博士后杜明娟为并列第一作者,Lerner教授和张宏恺博士为并列通讯作者。论文作者中的其他SIAIS人员包括研究生刘笑、孙璟莹,工程师王玮和研究助理辛秀。
离子通道是一类重要的药物靶点,其结构或功能异常导致包括疼痛、自身免疫疾病、肿瘤在内的各种疾病。在靶向离子通道的药物开发领域,制药界越来越关注开发特异性和药效更好的生物类药物。现有的离子通道生物类药物(包括临床用药和临床试验中的药物)均来自于生物毒素及其衍生物。例如,齐考诺肽(Ziconotide)是一种芋螺毒素,它是N-型电压敏感型钙通道拮抗剂,具有显著抗神经病理性疼痛的作用,其强度是吗啡的300倍,且长时间使用该药不会产生耐受性和成瘾性。
动物的毒素多肽在上亿年进化中形成,富含靶向离子通道的活性多肽,极具药物开发价值。但受限于这些毒素的筛选和分离难度,尚未找到一种充分发掘这些毒素潜在药物价值的方法。Lerner教授课题组提出了一种基于自分泌的创新性高通量筛选方法,能够快速筛选出针对膜蛋白的抗体和多肽,并对其进行优化改造,用于药物开发。
离子通道Kv1.3(Kv1.3)在激活的效应记忆性T细胞(TEM细胞)中高表达,阻滞Kv1.3可以特异地抑制TEM细胞的激活和扩增,从而遏制自身免疫疾病的发展。在这篇论文中,Lerner教授课题组应用上面所述的高通量筛选方法,成功筛选并改造出可以高效抑制Kv1.3的毒素多肽。
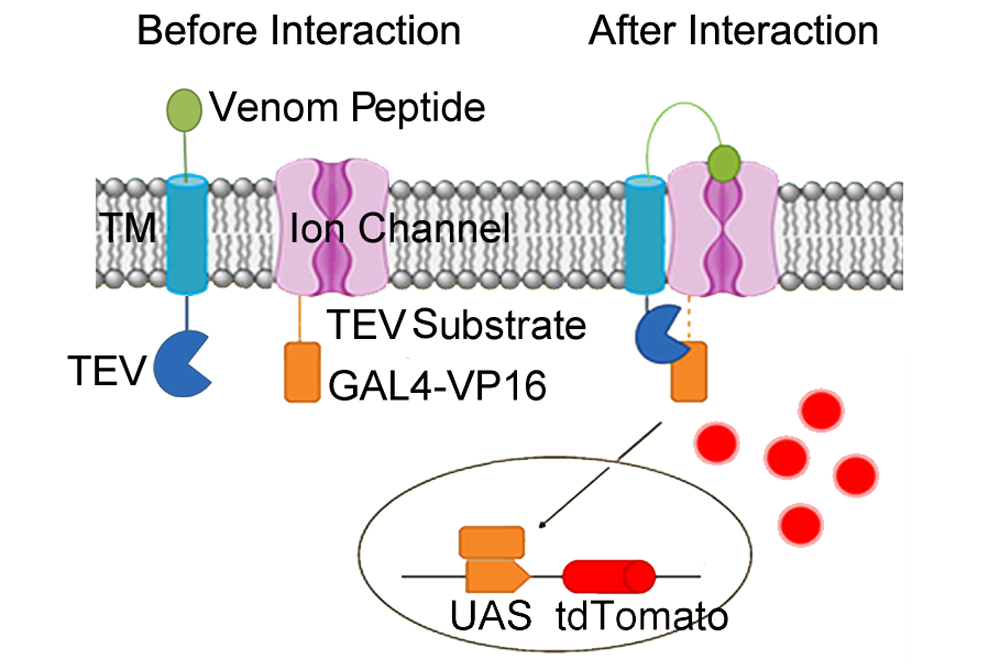
首先,研究者们构建了一套基于自分泌检测Kv1.3与毒素多肽结合的报告系统。在该系统中,毒素多肽可被血小板源生长因子受体跨膜区(PDGFR-TM)锚定到细胞膜上,跨膜区胞内端与TEV蛋白酶融合表达。Kv1.3通过TEV蛋白酶底物序列与人工转录因子GAL4-VP16相连。Kv1.3与毒素多肽结合时,TEV蛋白酶剪切其底物释放GAL4-VP16,激活荧光蛋白报告基因的表达。表达荧光蛋白的细胞可用细胞流式技术进行分选。
研究者们先通过序列比对,从毒素数据库中挖掘出可能会作用于Kv1.3的589种毒性肽。他们利用DNA高通量合成技术合成这些毒性多肽基因,构建了毒素多肽基因文库。利用基于自分泌的筛选方法进行多轮富集,他们筛选到27种可能会作用于Kv1.3的毒性多肽,其中的25种是已知的Kv1.3阻断剂,从而证明了该方法的有效性。剩下的两种毒性肽中,有一种之前被认为是可能的钾离子通道拮抗剂,而另一种来源于蝎子的毒性肽CllTx1在后续的验证测试中被证实为一种新颖、高效的Kv1.3拮抗剂。
研究者们意识到,这个系统不仅对于筛选天然毒素库非常有用,而且还能用于筛选一种给定毒素的人工变体或“类似物”以发现具有最佳药物特性的毒素。为了证明这一点,他们对海葵毒素多肽ShK进行改造,构建了近一百万种具有长效作用特点的ShK类似物进行筛选。筛选到的ShK类似物S1-2表现出高效的Kv1.3阻断能力,并能在大鼠DTH模型体内有效抑制炎症反应。值得注意的是,S1-2对一系列与Kv1.3高度相似的离子通道没有脱靶效应。
在未来的研究中,Lerner课题组打算使用这种方法,筛选更大的毒素数据集,以找到更多的候选药物。Lerner教授说:“我们特别感兴趣的是找到阻断疼痛相关钠离子通道的毒素。”



 沪公网安备 31011502006855号
沪公网安备 31011502006855号