我校物质学院季泉江教授课题组揭示了人类病原菌依赖小分子葡萄胺(staphylopine)识别并捕获过渡金属离子的新机制,近日,相关成果以“Mechanistic insights into staphylopine-mediated metal acquisition”为题,于国际知名学术期刊《美国科学院会刊》(PNAS)上在线发表。
过渡金属离子是非常重要的营养物质,生物体内超过30%的蛋白含有过渡金属离子。其能够作为酶反应的催化中心,或者保持功能蛋白质的结构完整,以及作为信号分子行使功能。金属离子的获取对病原细菌极为重要,是病原菌成功侵入宿主、繁殖自身、导致疾病的关键。金黄色葡萄球菌(Staphylococcus aureus)是一种极具危害的革兰氏阳性菌,轻可引起轻微的皮肤化脓感染,重则导致危及生命的重大感染,如伪膜性肠炎、肺炎、全身化脓性感染等。研究金黄色葡萄球菌如何侵入人类宿主并引发疾病的机制,对于预防感染和发展相应的治疗手段非常关键。2016年,《Science》曾报道了一种新的小分子金属螯合剂葡萄胺,由Cnt转运子上游的三个蛋白CntK/L/M合成。进一步研究发现,它能够结合并调节Ni2+、Zn2+、Co2+等过渡金属离子的转运,从而导致金黄色葡萄球菌的致病性。但葡萄胺/金属离子复合物的识别和转运的分子机制尚不清楚。
季泉江课题组通过等温量热滴定分析(ITC)发现,溶质结合蛋白CntA会有效结合葡萄胺/金属离子复合物,如葡萄胺/Co2+、葡萄胺/Ni2+等,但与单独的小分子葡萄胺或二价金属离子没有相互作用。随后,课题组成功解析了与金属离子转运相关的CntA蛋白单体以及CntA/葡萄胺/金属离子复合物的多种晶体结构,并发现葡萄胺/金属离子的识别会导致CntA结构构象上非常显著的变化。研究中还发现,CntA结合口袋中与葡萄胺/金属离子的识别密切相关的10个氨基酸残基(Y27、W103、R140、R225、R393、Q404、W406、Y410、N423、Y497),从分子层面揭示了CntA与葡萄胺/金属离子复合物的相互作用模式。
同时,利用课题组自主开发的金黄色葡萄球菌中基于CRISPR/Cas9的基因组编辑技术(JACS, 2017, 139, 3790),研究人员快速高效地实现了基因组上5个关键位点的突变,证实葡萄胺/金属离子复合物的转运识别过程对过渡金属获取的关键作用。这些研究揭示了金黄色葡萄球菌中CntA与小分子螯合剂葡萄胺及金属离子(Zn2+、Co2+、Ni2+)的相互作用模式,破解了金黄色葡萄球菌中Cnt转运子识别和捕获金属离子的分子机制,拓展了金黄色葡萄球菌的致病机制研究。这一研究也为其它病原菌中新型过渡金属攫取机制研究和新型治疗手段开发奠定了基础。
该论文中,季泉江课题组博士后宋立强为论文第一作者,2016级硕士研究生张翼飞为论文第二作者,季泉江为通讯作者,上科大为第一完成单位。该研究得到了科技部重点研发计划、基金委重大研究计划等项目的支持。
论文链接:
http://www.pnas.org/content/early/2018/03/21/1718382115
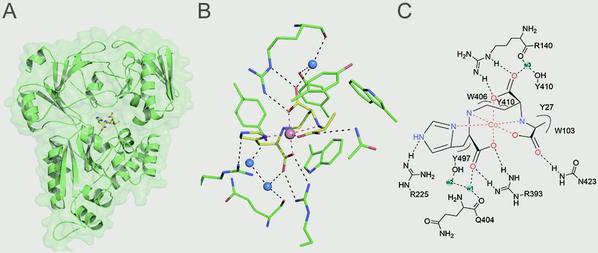
CntA/葡萄胺/Co2+复合物的三维结构. ( B/C) CntA与葡萄胺/Co2+的相互作用示意图


 沪公网安备 31011502006855号
沪公网安备 31011502006855号