近日,物质学院季泉江课题组在知名期刊《细胞•化学生物学》(Cell Chemical Biology)发表了题为“A Highly Efficient CRISPR-Cas9-Based Genome Engineering Platform in Acinetobacter baumannii to Understand the H2O2-Sensing Mechanism of OxyR”的研究论文,首次在鲍曼不动杆菌中建立了高效的基因组编辑平台。该平台利用RecAb重组酶/CRISPR-Cas9及APOBEC1胞嘧啶脱氨酶,实现了对多种鲍曼不动杆菌菌株的精确基因删除、插入、点突变及C→T转变,并基于这些编辑方法探究了OxyR的活性氧感应机制及多重耐药菌株XH386对亚胺培南和舒巴坦的耐药机制。

近几十年来抗生素广泛使用,多重耐药甚至全耐药的超级细菌不断出现,造成的病人严重感染及死亡病例与日俱增,对人类健康造成重大威胁。鲍曼不动杆菌(Acinetobacter baumannii)是一种危害极大的人类病原菌,在世界卫生组织(WHO)于2017年发布的12种被列为最高优先级的超级细菌名单中位列榜首,强调了耐药型鲍曼不动杆菌感染的严重性和开发新型治疗方法的急迫性和重要性。新型治疗方法的开发离不开使用遗传操作方法对鲍曼不动杆菌的致病和耐药机制进行解析,然而当前的鲍曼不动杆菌遗传操作方法,如非复制许可质粒法和重组酶催化重组法等,较为费时和低效,难以实现精确的无痕编辑。
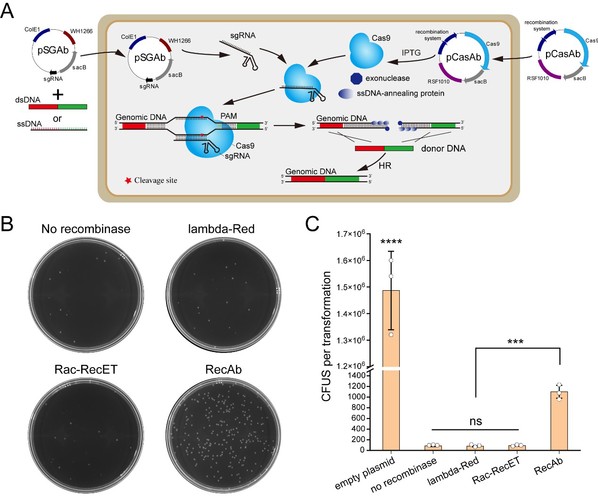
图1.鲍曼不动杆菌中的pCasAb-pSGAb/RecAb基因组编辑平台。
(A)pCasAb-pSGAb/RecAb的工作流程图。(B,C)仅RecAb重组系统能够有效介导鲍曼不动杆菌中CRISPR-Cas9造成的基因组双链DNA断裂的修复。
研究人员发现鲍曼不动杆菌自身的重组系统,以及广泛使用的来自于大肠杆菌噬菌体的λ-Red和RecET重组系统均不能介导鲍曼不动杆菌中CRISPR-Cas9造成的基因组双链DNA断裂的修复。然而,一种来自于鲍曼不动杆菌特殊菌株IS123的RecAb重组酶系统能够高效修复鲍曼不动杆菌中CRISPR-Cas9造成的基因组双链DNA断裂。因而,通过联合RecAb和CRISPR-Cas9, 研究人员建立了鲍曼不动杆菌中pCasAb-pSGAb/RecAb基因组编辑平台,在不同鲍曼不动杆菌菌株中均实现了高效且无痕的基因删除和插入操作。同时,研究人员还基于pCasAb/pSGAb双质粒系统,提出了一种两步法In-Del策略,可对鲍曼不动杆菌基因组任意位点进行精确的点突变操作。通过应用In-Del策略,研究人员对OxyR蛋白活性口袋中的13个保守氨基酸执行了丙氨酸扫描突变,揭示了新的活性氧感应机理。

图2. 基于pCasAb/pSGAb的In-Del策略及其在OxyR活性氧感应机制解析上的应用。
(A)In-Del策略的工作流程图。(B)利用In-Del策略对OxyR活性感应口袋氨基酸的扫描突变。(C)OxyR新的活性氧感应机理。
此外,为实现耐药质粒和可移动元件的有效编辑和进一步简化基因编辑流程,研究人员通过融合表达胞嘧啶脱氨酶与Cas9 (D10A)切口酶,构建了单质粒pBECAb碱基编辑系统,可在鲍曼不动杆菌中执行高效的C→T转变。应用pBECAb单质粒系统将氨基酸密码子(CAA、CAG、CGA或TGG)转变为提前出现的终止密码子(TAA,TAG或TGA),研究人员对多重耐药鲍曼不动杆菌XH386菌株的三个β-lactamase基因进行了单独与组合失活,揭示了它们在亚胺培南与舒巴坦耐药中发挥的具体功能。
本文第一、第二作者分别为季泉江课题组博士后王宇和研究生王志鹏,通讯作者为季泉江教授。此研究得到了浙江大学附属邵逸夫医院俞云松教授及其课题组成员的帮助。本论文相关研究成果已进行了专利申请(申请号:201910644444.1和201910644324.1)。该研究得到了 “生物大分子动态修饰与化学干预”重大研究计划培育项目、上海市科委青年科技启明星计划等项目的支持。
值得一提的是,近年来季泉江课题组基于不同策略,已在包括金黄色葡萄球菌、绿脓杆菌和肺炎克雷伯菌在内的多种人类主要病原菌中开发出了相应的高效基因组编辑工具,并应用这些工具和结构生物学等方法对病原菌的致病及耐药机制,特别是过渡金属攫取机制方面进行了深入研究。课题组开发的基因组编辑工具均可在质粒分享平台Addgene上进行获取(https://www.addgene.org/Quanjiang_Ji/)。
原文链接:https://www.cell.com/cell-chemical-biology/fulltext/S2451-9456(19)30277-6


 沪公网安备 31011502006855号
沪公网安备 31011502006855号