近日,上海科技大学免疫化学研究所特聘教授范国平/副研究员祝献民研究团队在Springer Nature旗下的国际学术杂志Oncogene发表了题为 “Single-cell RNA sequencing reveals the heterogeneous tumor and immune cell populations in early-stage lung adenocarcinomas harboring EGFR mutations“ 的研究成果。该研究运用高通量单细胞转录谱测序技术,获得了超过十二万个肿瘤和微环境单细胞的转录组数据。通过系统的生物信息学分析,研究团队揭示了早期肺癌细胞及免疫微环境的异质性和治疗癌细胞的新药物靶点。

肺腺癌(lung adenocarcinomas, LUAD)是非小细胞肺癌(NSCLC)最常见的亚型,在女性、年轻患者和非吸烟患者中发病率较高。而肺腺癌的EGFR基因突变在亚洲女性中尤为多见。理解肺腺癌肿瘤内的细胞异质性可以辅助药物靶点的发现和新型治疗策略的研发,对精准医疗意义重大。然而,以往对NSCLC的单细胞RNA测序(scRNA-seq)研究往往没有针对某一特定分期的特定肿瘤类型。
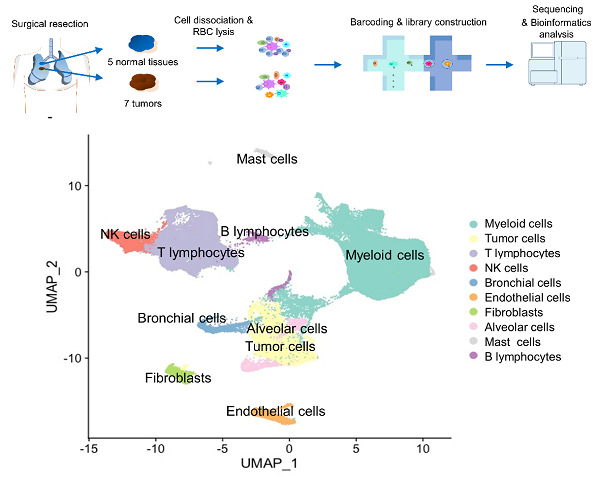
研究团队针对EGFR突变的早期肺腺癌组织和癌旁正常肺组织细胞的全基因转录谱开展研究。 他们首先收集患者新鲜肿瘤样本和癌旁组织制作了单细胞悬液,运用10XGenomics高通量单细胞RNA测序技术,共得到125674个高质量的单细胞的转录组数据。在此基础上,研究团队系统分析了不同类型的有EGFR基因突变肺腺癌细胞,以及与癌细胞相互作用的由不同细胞类型组成的肿瘤微环境。在肿瘤微环境中,髓系细胞和T细胞是肿瘤组织和癌旁组织中最丰富的间质细胞类型。该研究发现,肿瘤微环境中的相关巨噬细胞(TAM)在M1/M2中间状态,分泌很多趋化因子,具有促癌作用,并且肿瘤浸润性T细胞主要类型是耗竭性和调节性T细胞,这与特异表达CD1C基因的树突状细胞的增多有关。该研究通过生物信息学方法,还分析了细胞代谢、翻译起始、细胞周期和抗原呈递等基因表达通路的富集程度,将肺腺癌肿瘤细胞分为不同的亚型。此外还发现,受到浸润免疫细胞所分泌的IL1B等炎性细胞因子的刺激,肿瘤细胞的ELF3基因被上调,从而激活PI3K/Akt/NF-κB通路,上调了与增殖和抗凋亡相关的肿瘤基因表达。
该研究揭示了EGFR突变的早期肺腺癌肺腺癌的异质性,阐述了肿瘤细胞和微环境中不同细胞之间的相互作用机制,揭示了新的药物靶点,为靶向药物治疗肺腺癌开辟了新的思路。
上海科技大学的范国平教授、祝献民副研究员以及上海市肺科医院的张鹏教授是共同通讯作者。上海科技大学是第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号