1月24日 ,上海科技大学生命科学与技术学院刘艳芬课题组和白云课题组合作,在国际知名学术期刊Autophagy(《自噬》)在线发表了题为“Stress granule homeostasis is modulated by TRIM21-mediated ubiquitination of G3BP1 and autophagy-dependent elimination of stress granules”的研究论文,揭示了生理性和病理性应激颗粒稳态调节的内在机制,为ALS等神经退行性疾病的治疗提供了新的潜在靶点。
应激颗粒是一种由RNA和RNA结合蛋白形成的无膜细胞结构,在细胞受到压力的情况下,通过液液相分离(Liquid-liquid phase separation)存在于细胞质中。应激颗粒的形成与解聚是高度动态变化的过程,其通过调控细胞内蛋白质翻译和RNA加工的动态平衡以促进细胞在不利条件下存活。近年来,应激颗粒被发现与神经退行性疾病,如肌萎缩性侧索硬化症等密切相关,显示了它们在机体中的重要性。目前,对于应激颗粒的内平衡调控机理、病理性应激颗粒沉积形成及其促发神经退行性疾病的具体机制尚不清楚。
泛素化修饰是一种重要的蛋白质翻译后修饰,广泛参与细胞内多种生理过程的调控。本研究通过筛选存在于应激颗粒中的蛋白质质量控制因子,发现一种泛素连接酶TRIM21(tripartite motif containing 21)在亚砷酸盐诱导的氧化压力条件下会高度富集于应激颗粒中。过表达TRIM21会抑制应激颗粒的形成,而敲低TRIM21则促进应激颗粒的形成。进一步研究显示,TRIM21能对应激颗粒核心蛋白G3BP1进行K63连接的多聚泛素化修饰,抑制G3BP1自聚集,从而抑制应激颗粒的形成。此外,研究人员发现应激颗粒的清除过程还受到了自噬的调控。自噬是一种细胞内高度保守的信号通路,其介导蛋白质沉积、受损细胞器和外源入侵病原体等通过溶酶体进行降解。研究显示,在亚砷酸盐诱导的氧化应激条件下,特异性自噬受体SQSTM1和CALCOCO2能够与应激颗粒毗邻存在,与G3BP1相互作用,并参与介导应激颗粒的自噬依赖性清除。
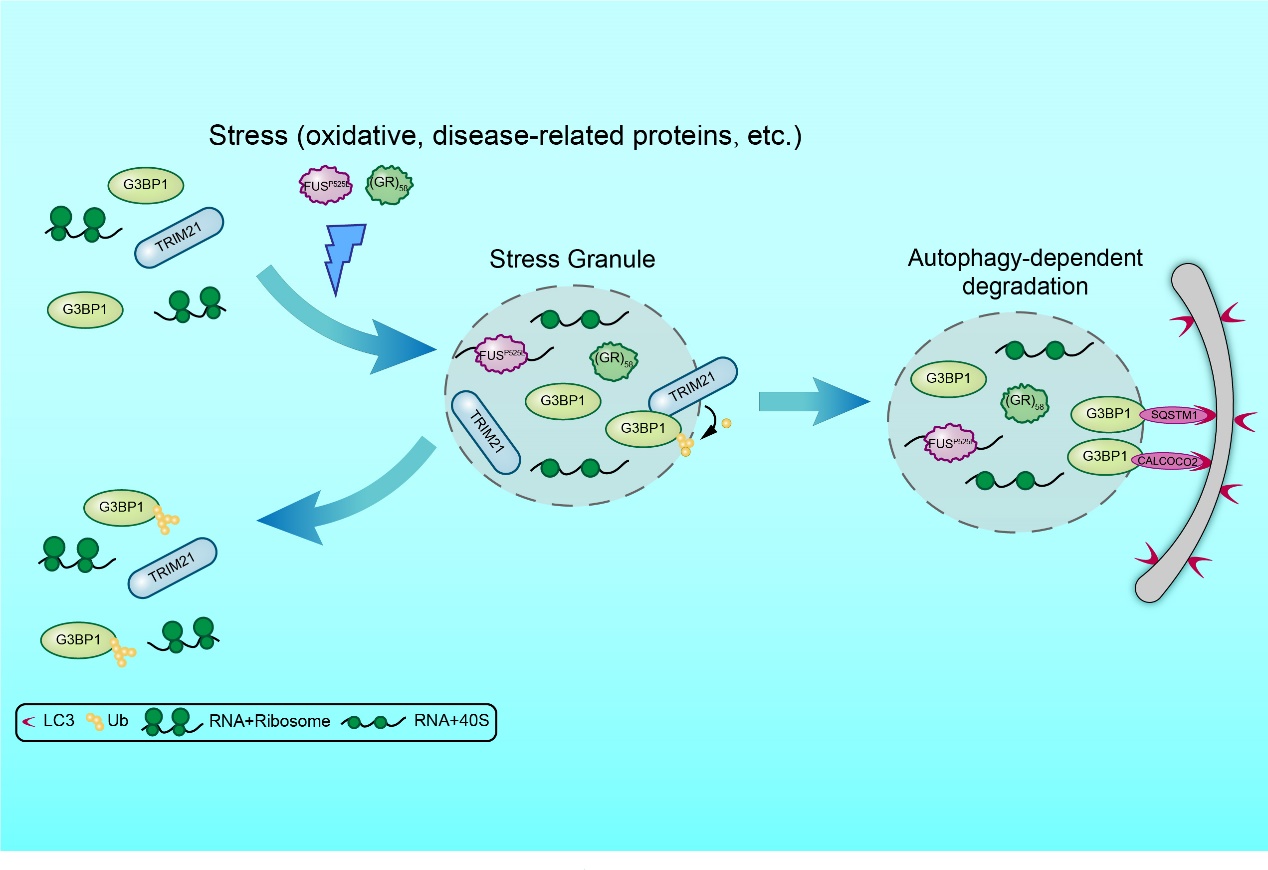
图1.TRIM21和自噬机制协同调节应激颗粒稳态的模式图。
本研究还探究了病理性蛋白突变沉积于应激颗粒后,是否同样受到上述机制的调控。C9orf72基因突变是导致ALS的主要原因之一,突变产生的二肽重复序列会在细胞内通过液液相分离的方式与应激颗粒形成胞质沉积。研究团队发现TRIM21同样可以抑制病理性应激颗粒的形成,同时病理性应激颗粒沉积也可经由特异性自噬途径进行清除(图1)。
刘艳芬课题组2018级博士杨翠薇、2020级博士王张顺和研究助理康英锦为本论文共同第一作者,刘艳芬教授和白云教授为通讯作者,上海科技大学为第一完成单位。
文章链接:https://www.tandfonline.com/doi/full/10.1080/15548627.2022.2164427


 沪公网安备 31011502006855号
沪公网安备 31011502006855号