4月4日,上海科技大学生命科学与技术学院团队与耶鲁大学医学院团队合作,在国际学术期刊《细胞-干细胞》(Cell Stem Cell)上发表题为“Generation of ventralized human thalamic organoids with thalamic reticular nucleus”的研究论文,报道了新的丘脑特异类器官构建方法。
利用人类胚胎干细胞、诱导多能干细胞建立的脑类器官是在培养皿里三维模拟大脑的重要工具。近年来,脑类器官得到了广泛关注与应用,并有望继续在探究脑发育、进化、疾病及治疗等方面提供技术支撑。如何构建更精细、复杂的脑类器官,是该技术目前面临的关键挑战。
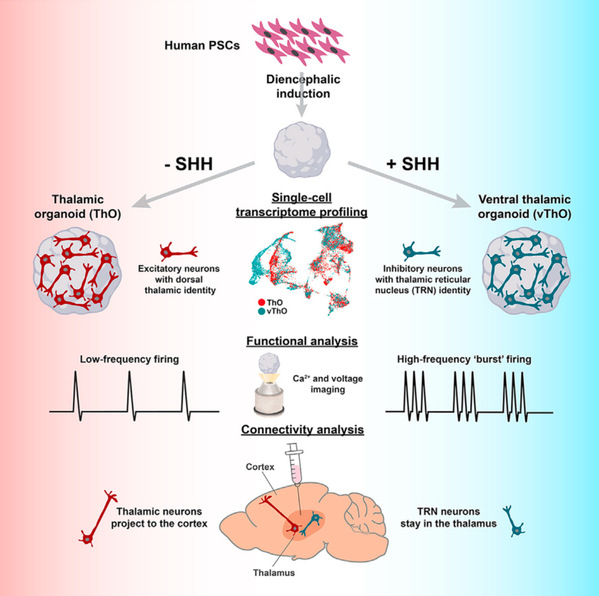
丘脑是脑中负责整合感觉信息,并将其传送至不同脑区的中枢结构。本团队前期首次实现了人类丘脑特异类器官的构建,其中主要富集了背侧丘脑起源的兴奋性投射神经元。然而,如何在丘脑类器官中重现核团特异性发育尚不明确。
本研究关注了起源于腹侧丘脑的网状核(thalamic reticular nucleus, TRN)。与诸多背侧丘脑核团不同,网状核富含抑制性神经元,在结构上位于背侧丘脑与大脑皮层之间,负责为丘脑-皮层间的功能连接提供抑制性反馈。网状核病变往往与多种神经发育疾病相关,包括智力障碍、自闭症谱系障碍、注意缺陷与多动障碍等。目前,尚缺乏研究人类网状核发育与功能的体外研究模型。
研究团队探索了人类胚胎干细胞向间脑(丘脑的起源区域)三维分化的定向诱导,以及腹侧丘脑模式发生的调控。基于筛选出的腹侧丘脑类器官分化方案,单细胞转录组及相应的细胞类型、功能等分析表明,类器官中富集了与背侧丘脑类器官差异化的细胞谱系,其中尤其富集了具备网状核特征的抑制性神经元类群。
基于该类器官模型,本研究首次在人类特异的体外模型中探索了网状核中富集表达的、疾病相关基因的功能,包括PTCHD1和ERBB4基因。研究表明,这两种基因的表达异常并不会影响丘脑谱系分化,包括网状核抑制性神经元的分化。但是,分化神经元的电生理功能出现异常,且该功能异常很可能与钙激活钾离子通道的表达上调相关。
本工作首次实现了具备核团特性的人类腹侧丘脑类器官构建,为体外重现人类特定脑区、核团发育提供了新的三维模型,尤其为了解人类丘脑核团发育及病理机制提供了全新方法。向阳飞、In-Hyun Park为本文的共同通讯作者。
论文链接:https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(23)00078-4


 沪公网安备 31011502006855号
沪公网安备 31011502006855号