12月21日,上海科技大学生命科学与技术学院孙博课题组在学术期刊Advanced Science上在线发表题为“Joint efforts of replicative helicase and SSB ensure inherent replicative tolerance of G-quadruplex”的研究论文,报道了复制型解旋酶和单链DNA结合蛋白协同工作,以保证复制过程中复制体对G-四链体耐受性的分子机制。
本研究以噬菌体T7复制体为研究模型,结合单分子光镊(Optical Tweezers)、荧光共振能量转移(FRET)及系综生化实验(Ensemble biochemical experiment)等多种方法,在体外重构DNA复制过程,系统研究了复制体如何响应分子内预先形成G4结构,发现了复制体克服G4阻碍的新路径。
G-四链体(G-quadruplex or G4)是一种非经典的核酸高级结构,通常由超过两层的四分体组成。大量研究证实G-rich序列在多数生物基因组中普遍存在,而G4结构的形成在调控DNA复制、转录、端粒维持和其它生物过程中具有重要功能。在DNA复制过程中,G4被认为容易导致DNA双链断裂及基因组不稳定。然而,复制体如何有效地克服G4结构、避免复制失败仍然不清楚。
本工作通过单分子和系综实验进行T7 DNA聚合酶(T7 DNA polymerase, T7 DNAP)的引物延伸检测,发现T7 DNAP无法在解链合成过程中克服G4结构。进一步实验发现DNA分子内的G4结构与DNA双链的交界处形成的叉状结构会引起非活性T7 DNAP的结合。除了G4结构外,这些非活性T7 DNAP也成为活性DNAP不可逾越的障碍,阻碍了DNA合成的进行。
T7解旋酶可以移除非活性的T7 DNAP并且对滞后链(Lagging strand)的G4结构解旋,为复制叉的推进扫清了障碍(图1A)。虽然T7解旋酶自身无法帮助T7 DNAP克服位于前导链(Leading strand)上G4结构,但T7解旋酶可以与单链DNA结合蛋白gp2.5协同工作并维持前导链G4结构的单链DNA状态,从而允许T7 DNAP的合成及复制叉的前进(图1B)。
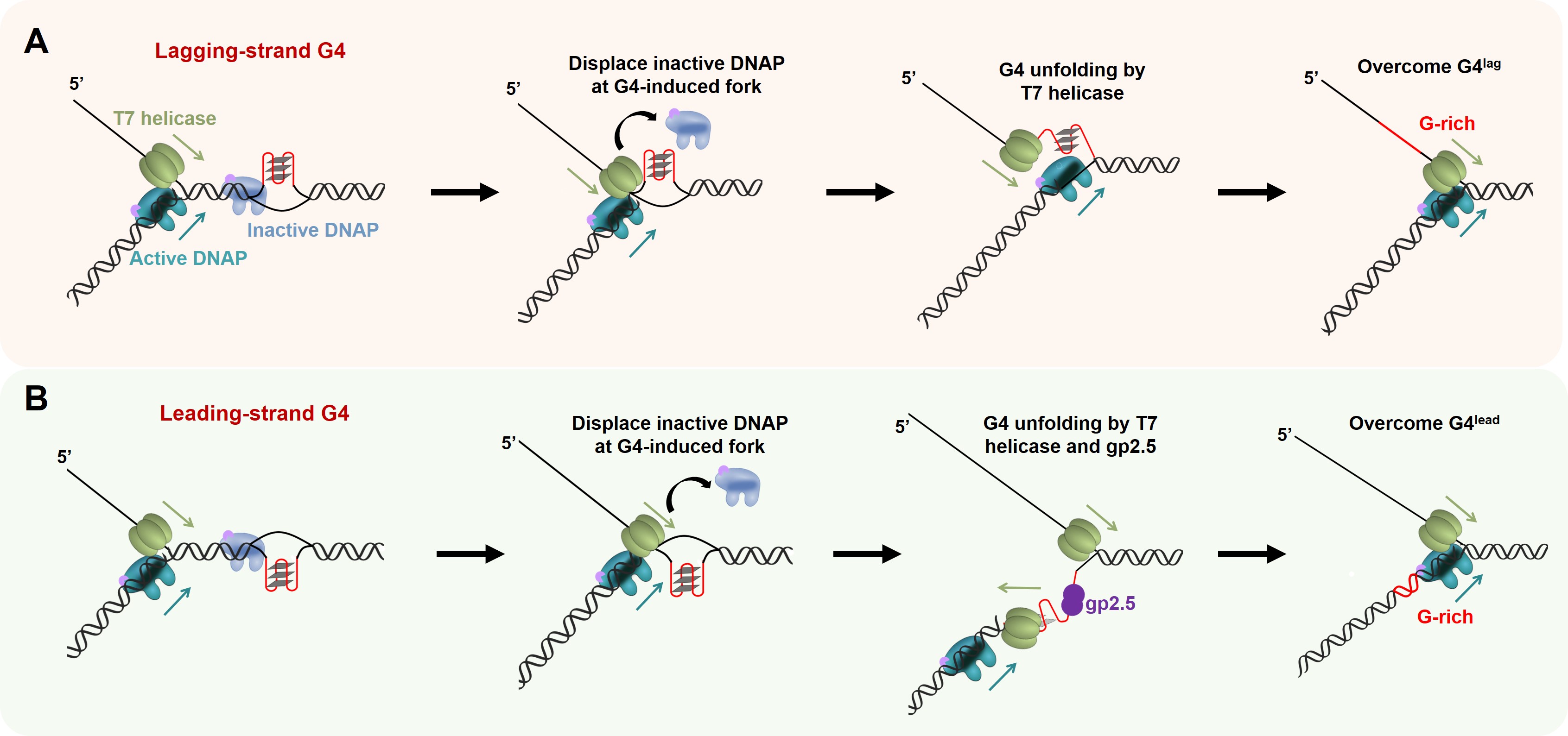
图1:T7复制体复制G4的分子机制模型图。A. 滞后链含有G4结构时,T7解旋酶移除结合在叉状结构处非活性的T7 DNAP并且解链滞后链的G4结构,帮助T7 DNAP克服障碍。B. 前导链含有G4结构时,T7解旋酶与gp2.5协同工作,协助T7 DNAP克服G4完成复制。
本工作首次报道复制型解旋酶可以解旋G4结构,并与单链DNA结合蛋白一起确保DNAP顺利合成G-rich序列,揭示了G4调控DNA复制的动力学分子机制,解析了T7复制体自身克服G4的能力及新路径,为探究新型复制重启路径提供借鉴,也为了解复制体如何应对高级DNA结构提供了新的思路。
上科大生命学院2023届博士生郭丽娟(已毕业)及2023级博士生鲍彦伶为共同第一作者,常任副教授孙博为通讯作者,上海科技大学为第一完成单位。上科大分子细胞平台的工作人员对该项研究提供了技术帮助。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202307696


 沪公网安备 31011502006855号
沪公网安备 31011502006855号