5月12日,上海科技大学生命科学与技术学院刘艳芬课题组在学术期刊Autophagy(《自噬》)上在线发表了题为“USP20 deubiquitinates and stabilizes the reticulophagy receptor RETREG1/FAM134B to drive reticulophagy”的研究论文,阐明泛素化修饰在内质网选择性自噬降解中的调控机制。

自噬是一种细胞内重要的降解机制,通过形成自噬小体将受损的蛋白质、细胞器和外源微生物等物质包裹,并将其运送至溶酶体进行降解,保持细胞的稳态和健康。选择性自噬则是一种具有特异性的细胞器降解方式,能有针对性地消除不同类型的细胞器。
作为细胞内最大的有膜细胞器之一,内质网具有多种重要功能,包括蛋白质和脂质的合成、蛋白质质量控制、维持钙离子稳定以及促进细胞器间通讯等。维持内质网稳态对细胞的正常运行至关重要,及时清除受损的内质网尤为重要。内质网上存在多种自噬受体负责介导其选择性自噬降解的过程。蛋白质的泛素化修饰在自噬调控的各个阶段都有重要作用,但目前对于泛素化修饰在内质网自噬调控中的具体作用还所知甚少。
刘艳芬课题组长期研究细胞自噬的调控机制,以及包括内质网、线粒体、应激颗粒在内的选择性自噬的机理。本研究通过遗传筛选参与自噬的去泛素化酶家族基因,发现其中的USP20在饥饿条件下能进一步促进自噬的发生,并探究了其作用机制。
作为细胞质蛋白质,USP20通过FFAT基序与内质网膜蛋白VAPA/B的MSP结构域相互作用,定位于内质网。研究者进一步探究了USP20对内质网自噬的调控作用,发现USP20通过调控内质网自噬受体RETREG1的去泛素化来稳定其不被泛素-蛋白酶体途径降解。USP20与RETREG1在内质网上并非均匀分布,两者在特定区域呈现一定的共定位,而饥饿条件则增强这种共定位的比例。
USP20对RETREG1去泛素化调节,使后者与自噬核心蛋白LC3更好地结合,从而诱导内质网自噬的发生。同时,USP20也能促进RETREG1与内质网膜蛋白VAPA/B的相互作用,进而引导由VAPA/B招募的自噬起始复合物蛋白到内质网特定区域,进一步促进内质网自噬的发生(图1)。
这项研究阐明了泛素化修饰在内质网自噬中的重要调控机制,为深入理解选择性自噬作用机理提供了新的线索。一些与内质网相关的疾病(如神经退行性疾病等)与内质网自噬异常密切相关,这项发现为相关疾病的治疗和预防提供了新的靶点和策略。
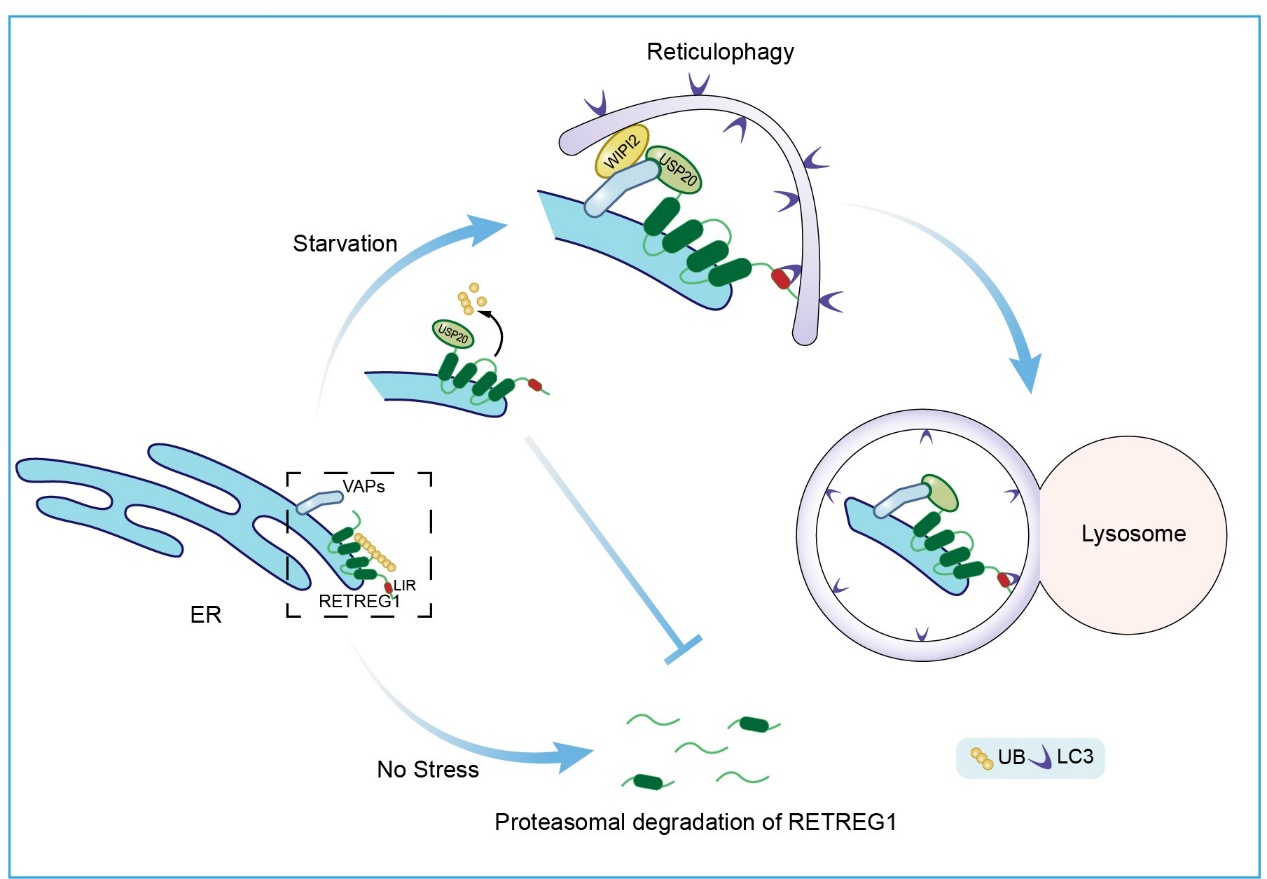
图1.USP20调控RETREG1去泛素化并促进内质网自噬。
上海科技大学生命科学与技术学院2020级博士研究生张曼为该论文的第一作者,常任副教授刘艳芬为通讯作者,上海科技大学为第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号