6月3日,上海科技大学生命科学与技术学院Tomoyasu Sugiyama研究团队在《核酸研究》(Nucleic Acids Research)发表了题为“The fission yeast ortholog of Coilin, Mug174, forms Cajal body-like nuclear condensates and is essential for cellular quiescence”的研究成果,首次在单细胞真核生物-裂殖酵母(Schizosaccharomyces pombe)中鉴定出Coilin蛋白的同源物Mug174。研究证实,Mug174通过相分离机制形成Cajal body(卡哈尔体),并揭示了Coilin蛋白维持细胞静息期(G0期)的调控机制。这为理解Coilin/Cajal body功能障碍与人类疾病(如神经退行性疾病)之间的联系提供了新的视角。

Cajal body是定位在细胞核中的一种无膜结构,作为备受关注的核体之一,Cajal body在snRNPs(small nuclear ribonucleoprotein particles, 小核糖核蛋白复合体)和snoRNPs(small nucleolar ribonucleoprotein particles, 小核仁核糖核蛋白)的生物发生过程中起着重要作用。此外还参与调控无义介导的mRNA衰变、基于RNA干扰(RNAi)的基因沉默、病毒感染以及应激反应等关键生物学过程。Cajal body的异常与如脊髓性肌肉萎缩症(SMA)和Purkinje细胞退化症(PCD)等多种神经退行性疾病相关。Coilin蛋白是Cajal body中的一个标志性成分,对维持Cajal body结构的完整性至关重要,但其如何调控Cajal body的形成以及具体功能仍不明确。由于在秀丽隐杆线虫和酵母等模式生物中尚未鉴定出Coilin,因此在这些生物中对其进行研究将有助于深入理解Coilin的功能。
Tomoyasu Sugiyama研究团队长期以裂殖酵母为模式生物研究核体。该工作通过对比Mug174和Coilin蛋白,发现二者在序列和结构上具有相似性。进一步研究发现Mug174能与Cajal body的组分U RNAs和TMG合酶Tgs1相互作用。据此研究团队得出Mug174是裂殖酵母中Coilin的同源物的结论。
该工作还探究了Mug174 /Coilin形成Cajal body的机制。利用1,6己二醇(一种能够破坏相分离液滴的小分子)处理细胞,发现Cajal body会发生可逆性解聚。通过体外纯化的蛋白重构相分离过程,发现Mug174具有形成液-液相分离液滴的特性,证明Mug174 /Coilin通过相分离促进Cajal body的形成。
研究还发现了Mug174/Coilin可能的新功能。在细胞的G0期,Mug174/Coilin不仅参与调控前体mRNA的剪接,还会抑制rRNA转录。这种抑制对于维持G0期细胞的生存至关重要。这些发现对理解真核生物 Coilin 蛋白和Cajal body的进化起源与分子机制有重要的意义。
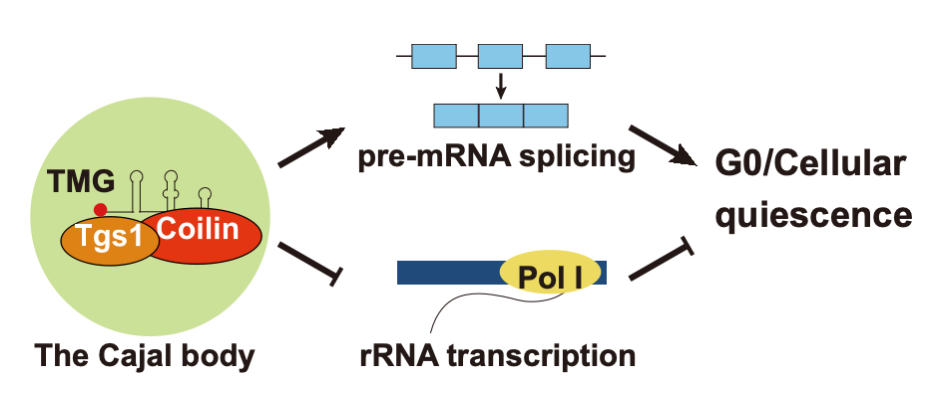
图1:裂殖酵母Coilin同源物调控静息期(G0期)的机制
上海科技大学生命学院2020级博士研究生邓小玲为该论文的第一作者,Tomoyasu Sugiyama为通讯作者,上海科技大学为第一完成单位。
文章链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkae463/7686744?login=true


 沪公网安备 31011502006855号
沪公网安备 31011502006855号