北京时间7月3日晚,上海科技大学免疫化学研究所教授杨海涛、免化所特聘教授/清华大学教授饶子和院士和复旦大学教授孙蕾等在国际学术期刊《细胞》(Cell)上共同发表了题为“TMPRSS2 and glycan receptors synergistically facilitate coronavirus entry”的最新研究,揭示了人类冠状病毒HKU1(HCoV-HKU1)同时利用细胞表面糖受体和蛋白受体入侵人体的精确分子机制,首次发现这两类受体在病毒入侵过程中展现出协同的工作机制。该研究不仅拓展了对冠状病毒如何入侵宿主这一关键过程的理解和认识,解决了冠状病毒受体研究领域长期以来悬而未决的一个关键科学问题,也为开发抗冠状病毒的新策略奠定了重要理论基础。

冠状病毒是影响人类生命健康和社会经济发展的一类重要病原体。本世纪以来引发多次全球性疫情(如SARS和新冠等),对全世界造成了空前的影响。冠状病毒入侵宿主的分子机制不仅是重要的科学问题,对指导新型抗病毒药物及疫苗开发更具有巨大科学价值。近三十年的研究表明,冠状病毒入侵宿主细胞时需要识别位于细胞膜表面的受体,而这些受体大致可以分为糖类受体和蛋白质类受体,但这两类受体之间的关系及精确的内在分子机制尚亟待解答。
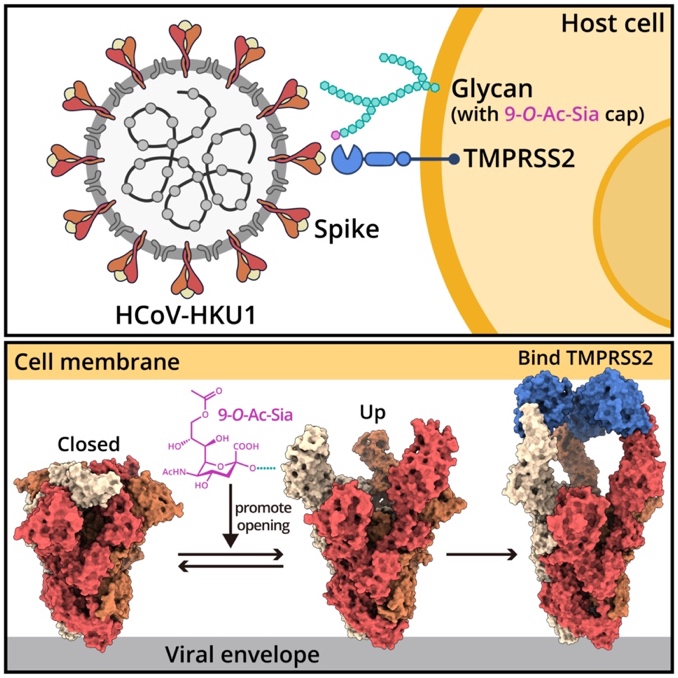
图1. 人类冠状病毒HKU1同时挟持细胞表面糖受体和蛋白质受体入侵人体的示意图。
人类冠状病毒HKU1是一种引发季节性呼吸道疾病的人类冠状病毒,在免疫功能低下和免疫缺陷人群中可能导致重症。目前研究表明,HCoV-HKU1入侵需要识别并结合位于宿主细胞膜表面的糖受体(糖受体识别决定簇为其末端的9-O-乙酰化唾液酸,即9-O-Ac-Sia)和蛋白受体(跨膜丝氨酸蛋白酶2,即TMPRSS2)。本研究通过冷冻电镜技术解析了HCoV-HKU1刺突蛋白(又名spike)在激活前态(inactive state)、糖激活态(glycan-activated state)、功能性锚定态(functionally anchored state)下的多个结构,完整描绘了冠状病毒刺突蛋白同时识别、结合人体细胞上两类受体的一系列动态过程。通过对不同状态下的结构分析,发现冠状病毒刺突蛋白不仅可以分别识别宿主细胞表面的糖受体与蛋白受体,而且病毒与这二者的识别出人意料地展现出协同过程,大大促进了病毒入侵宿主细胞的效率。该协同作用具体表现为(图1):病毒刺突蛋白与糖受体结合被激活,并展示出“up”构象,暴露出与蛋白受体结合的功能区,促使其与蛋白受体的进一步结合,从而介导病毒囊膜与细胞膜的融合,完成入侵过程。对复合物结构的深入分析进一步揭示了刺突蛋白如何识别糖和蛋白受体的精确分子机制(图2),其中TMPRSS2通过一系列氢键和疏水相互作用与刺突蛋白的RBD区域远端相结合;而9-O-Ac-Sia则是结合在刺突蛋白的NTD结构域外围,并主要占据了其中两个疏水口袋P1和P2。这些发现为靶向刺突蛋白与受体互作界面的抗体设计等全新抗病毒策略提供了重要结构基础。
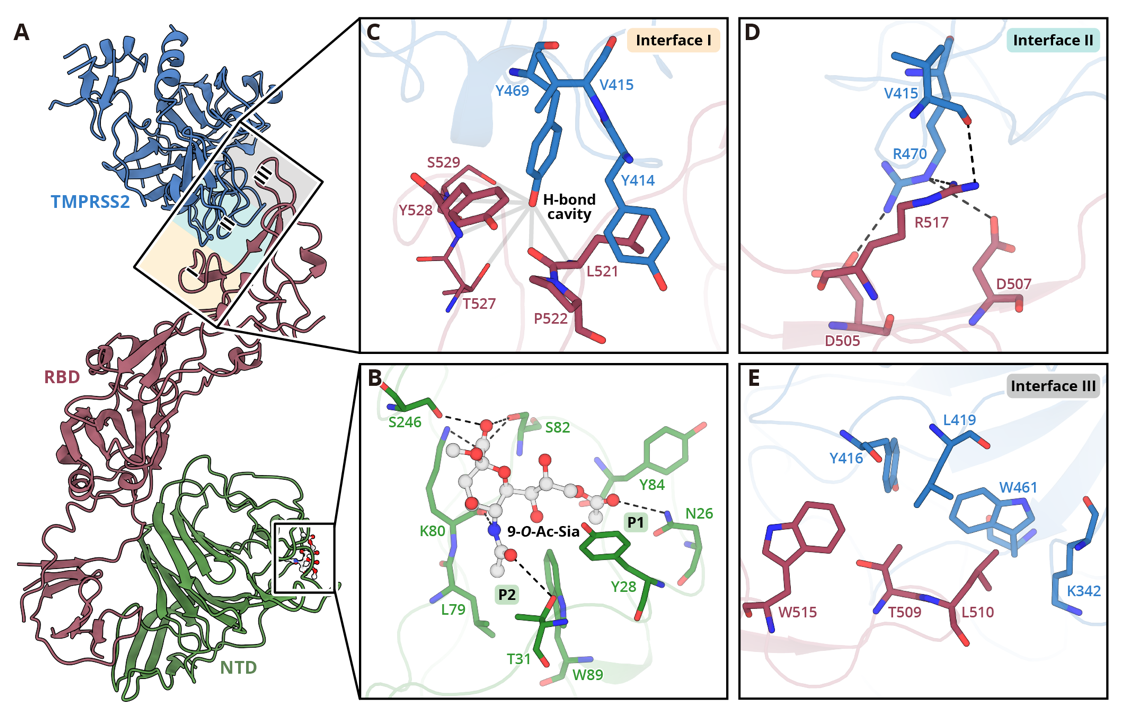
图2. 人类冠状病毒HKU1刺突蛋白分别识别糖受体和蛋白受体的精确模式
该研究还预测并分析了人类冠状病毒HKU1的潜在感染宿主范围。通过对不同物种来源的TMPRSS2的序列保守性分析,并随后测定其与病毒刺突蛋白的亲和力,发现骆驼、羊驼和大鼠的TMPRSS2在结合病毒刺突蛋白的关键氨基酸序列上与人源TMPRSS2高度保守。生物膜干涉实验进一步证实,上述三种动物来源的TMPRSS2均能有效结合病毒刺突蛋白。这些研究结果为阐明人类冠状病毒HKU1潜在感染的宿主范围提供了前瞻性理论依据,并对人类冠状病毒HKU1的预防和监控具有重要科学指导意义。
本项工作是该联合研究团队在冠状病毒研究领域的又一项重要突破。自新冠病毒暴发以来,该联合研究团队不仅在主蛋白酶和转录复制复合体等冠状病毒关键药物靶点的结构及药物研究中取得了一系列重大进展,也在病毒刺突蛋白及其中和性抗体开发方面硕果累累,并多次获得“中国科学十大进展”、“中国生命科学十大进展”和“中国年度重要医学进展”等荣誉。
本项工作由上海科技大学、上海临床研究中心、复旦大学、临港实验室、广州实验室等多家单位合作完成,上海科技大学为第一完成单位。上海科技大学免化所博士后王镐锋、博士研究生刘小策,复旦大学张翔博士,上海科技大学/临港实验室联培博士研究生赵卓前、卢宇驰为论文的并列第一作者。上海科技大学免化所和生命学院双聘教授杨海涛、免化所特聘教授/清华大学教授饶子和院士、复旦大学孙蕾教授为本论文共同通讯作者。中国海洋大学曹鸿志教授、广州实验室杨琪副研究员、南京大学郭航天博士也参与了本项工作。电镜数据收集在上海科技大学生物电镜中心完成。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号