近日,上海科技大学生命科学与技术学院孙博课题组与广州医科大学附属妇女儿童医疗中心李卫课题组合作在国际学术期刊《自然-通讯》(Nature Communications)在线发表题为“RPA transforms RNase H1 to a bidirectional exoribonuclease for processive RNA-DNA hybrid cleavage”(RPA转变RNase H1为双向核糖核酸外切酶,实现RNA-DNA杂合链的持续性降解)的研究论文,揭示了RNase H1独特的核酸外切酶活性。

核酸酶是催化核酸磷酸二酯键水解的一类蛋白,通过对核酸底物的特异性识别、降解,参与了包括DNA复制、修复及RNA转录、翻译等几乎所有核酸代谢过程,其功能缺失往往会导致遗传信息的不稳定及相应疾病的发生。根据切割模式的不同,核酸酶可为内切酶和外切酶:核酸内切酶从核酸分子内部切割,切割位点通常不连续,而核酸外切酶则从核酸分子末端切割,沿着核酸链连续切割核酸。根据切割方向,核酸外切酶又分为3’-5’和5’-3’两种。
自发现以来,RNase H1被认为是特异性降解RNA-DNA杂合链中RNA的核糖核酸内切酶,在多个核酸代谢过程中至关重要。然而,RNase H1介导的杂合链切割的动力学机制仍不清楚。本研究利用荧光光镊和荧光共振能量转移等单分子技术实时监测酵母RNase H1降解RNA-DNA杂合链的动态过程。实验发现RNase H1的核酸酶活性具有浓度依赖性:在高浓度下RNase H1主要通过内切酶活性降解RNA;而低浓度下的单个RNase H1呈现出3′-5′核糖核酸外切酶活性。这种定向的RNA外切降解具有周期性,每个周期以解旋6个杂合碱基对为前提,随后进行两次3个核糖核苷酸的切除。此外,复制蛋白A(Replication Protein A, RPA)作为单链DNA结合蛋白,不仅可以提高RNase H1对 RNA 3′-5′方向的降解速率和持续性,同时通过帮助解旋杂合链激活其5′-3′的外切酶活性(图1),从而保证RNase H1对杂合双链的持续双向降解。这些发现揭示了RNase独特的酶活特性,提供了RPA促进RNase H1降解杂合链的分子机制解释,为理解RNase H1的体内功能提供了新视角。
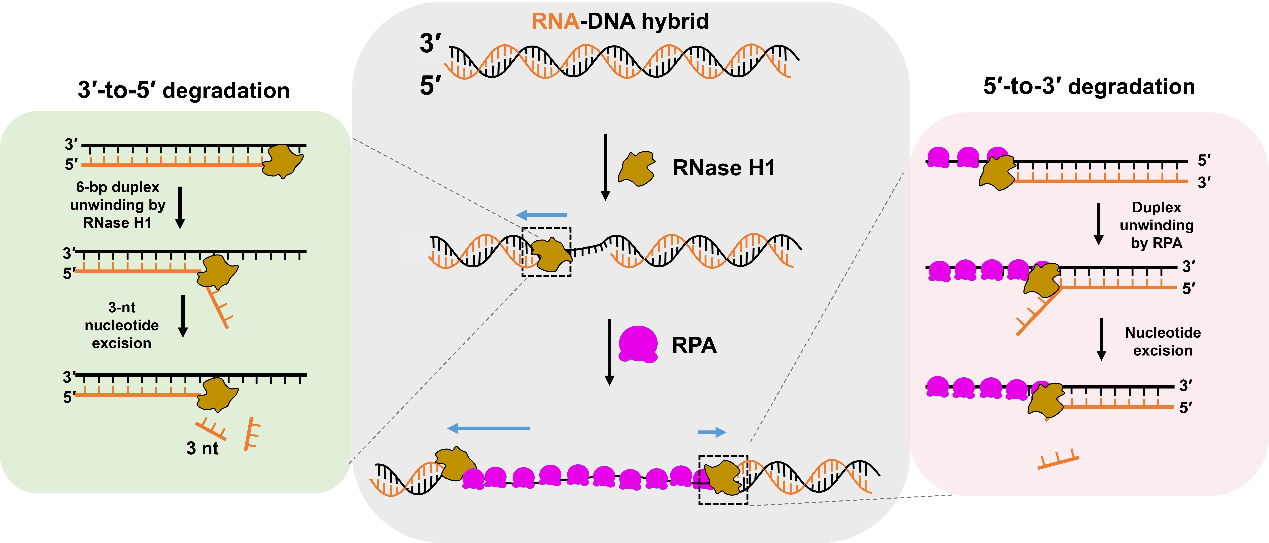
图1:RNase H1介导的双向RNA-DNA杂合核酸降解分子机制模型。
上海科技大学生命学院2021级博士生李亚楠和广州医科大学附属妇女儿童医疗中心的刘超研究员为本文共同第一作者,孙博教授和李卫研究员为共同通讯作者,上海科技大学为第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号