近日,上海科技大学生命科学与技术学院杜迪军课题组与西北农林科技大学李朝飞课题组合作在国际学术期刊《自然-通讯》(Nature Communications)发表了题为“Structural transition of GP64 triggered by a pH-sensitive multi-histidine switch”的研究论文,首次解析了III型病毒膜融合蛋白GP64融合前和融合早期中间状态的冷冻电镜(cryo-EM)结构,揭示了GP64介导病毒包膜与宿主细胞膜融合的分子机制。

包膜病毒(enveloped virus)通过与宿主细胞膜融合入侵宿主细胞。该融合过程通常由病毒表面的膜融合蛋白介导。基于结构特征,病毒膜融合蛋白可以分为I、II 和III型。不同的病毒膜融合蛋白采用不同的机制来触发膜融合反应,如受体结合、低pH诱导,或两者兼有,以及蛋白酶裂解触发。了解其分子机制,对于抗病毒药物和疫苗开发至关重要。GP64是一种III型病毒膜融合蛋白。在病毒入侵宿主细胞过程中,通过低pH诱导该蛋白构象变化来介导膜融合。GP64蛋白在膜融合过程中,需要经历从亚稳态融合前状态和中间状态,到稳定融合后状态的构象转变。2008年有研究者报道了GP64蛋白融合后状态晶体结构。但随后多年,GP64融合前状态和融合中间状态结构未能得到解析,其介导的膜融合机制尚不清楚。
本工作通过单颗粒冷冻电镜(cryo-EM)技术解析了GP64在融合前和早期中间状态的高分辨率结构,显示GP64是一个三聚体,包括7个结构域。三聚体界面的中心区域由结构域III、结构域V的螺旋D、PTMD和TMD组成;结构域I、II和IV位于分子的外围(图1)。GP64三聚体融合前结构呈三脚架状。其早期中间状态结构中一个单体的结构域I 逆时针向外旋转,另外两个单体与融合前单体结构基本相同(图1)。
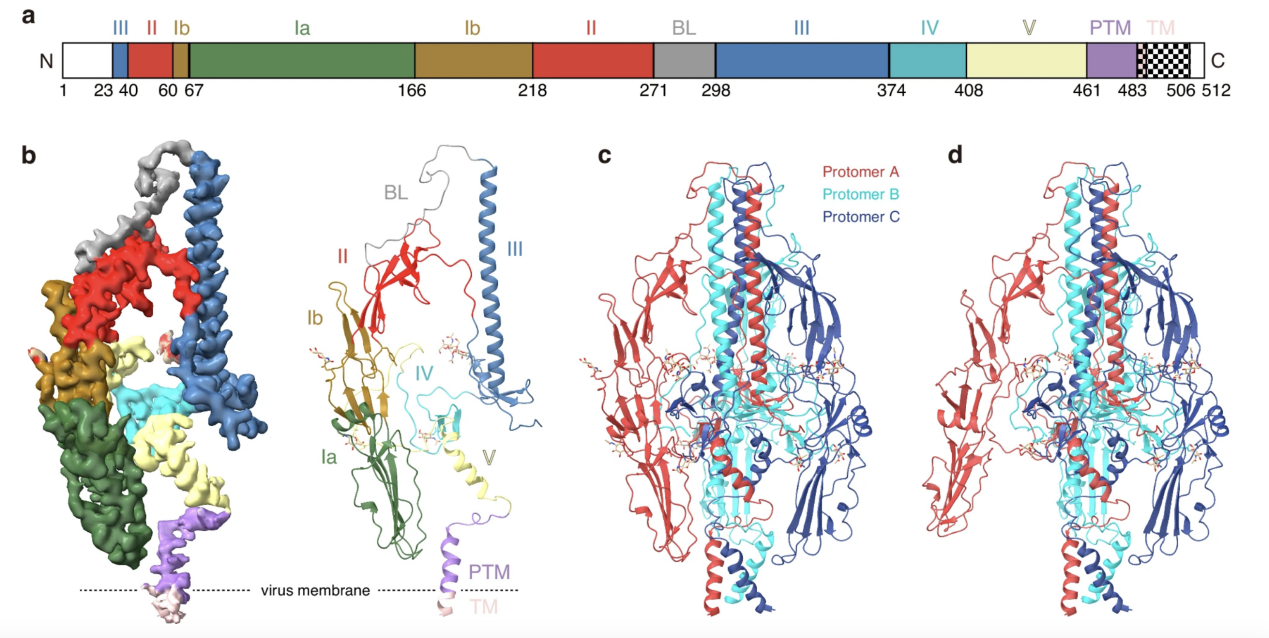
图1. GP64融合前和早期中间状态结构
研究团队通过比较GP64融合前、早期中间状态和融合后状态结构,揭示了其在膜融合过程中的构象变化特征。这些结构提示,位于GP64三聚体界面上的组氨酸在低pH诱导其构象变化过程中起重要作用。对这些组氨酸进行系统突变分析后发现,组氨酸H23, H245和H304在感知低pH,并触发膜融合的初始阶段起到了关键作用。这些组氨酸的功能通过合胞体形成和双染料标记等实验得到了验证。
本研究揭示了GP64介导膜融合过程中的分子机制(图2),为开发新的抗病毒药物和疫苗打下了基础。
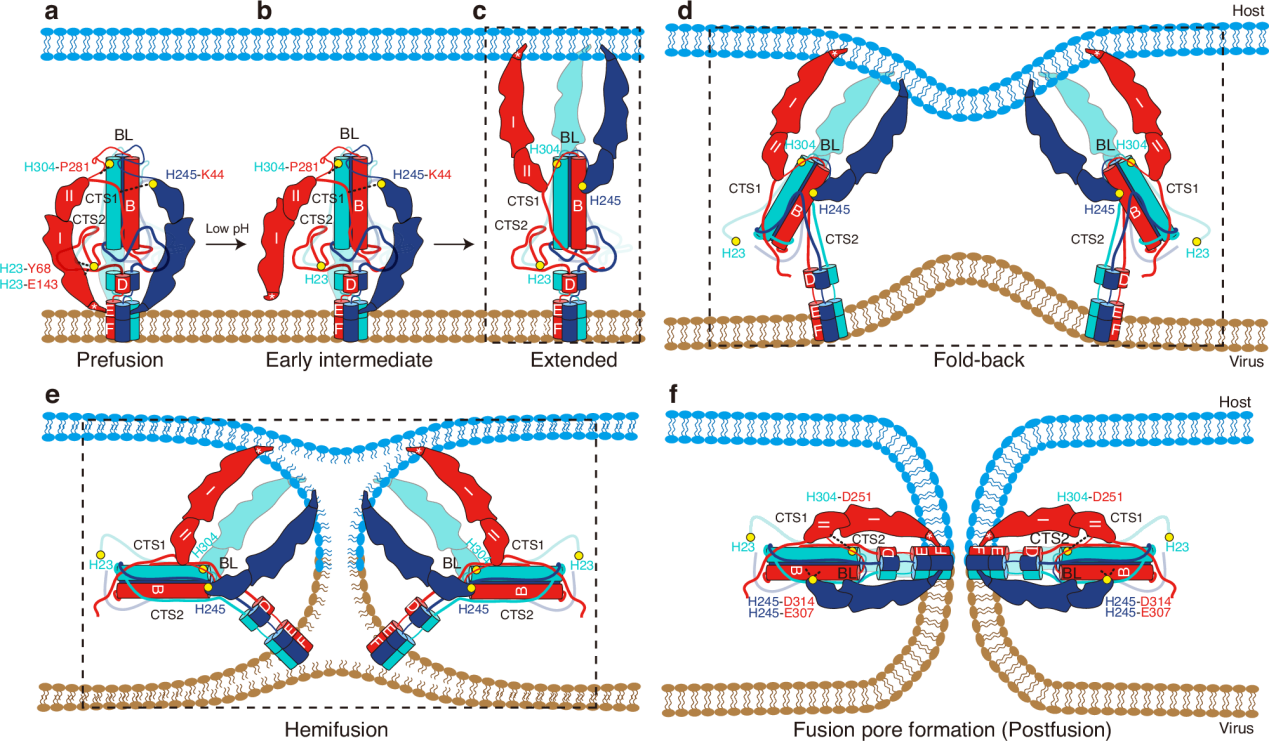
图2. GP64介导的膜融合的机制
上海科技大学生命学院博士后郭金两、2022级博士生李尚蓉和2020级博士生赵慧敏,以及西北农林科技大学2020级博士生白丽莎为本文共同第一作者。杜迪军教授和李朝飞教授为共同通讯作者,上海科技大学为第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号