9月27日,上海科技大学生命科学与技术学院李磊课题组在国际学术期刊《自然-通讯》(Nature Communications)上发表了题为“Metabolic regulation of cytoskeleton functions by HDAC6-catalyzed α-tubulin lactylation”的研究论文,报道了组蛋白去乙酰化酶HDAC6作为一种乳酰基转移酶,催化细胞骨架蛋白的乳酰化修饰,并调控细胞骨架的功能。
蛋白质乳酰化修饰是2019年在组蛋白上发现的一种新的翻译后修饰,广泛存在于细胞核和细胞质多种蛋白质中,可以调节染色质的基因转录,并受到细胞代谢水平的调控。最近有研究发现,乙酰基转移酶P300、TIP60以及丙氨酰tRNA合酶AARS可能作为乳酰基转移酶调控蛋白质乳酰化修饰,但细胞中蛋白质的乳酰化是否存在其他的调控方式仍不清楚。
本研究揭示了蛋白质乳酰化修饰新的调控方式:组蛋白去乙酰化酶HDAC6在细胞中表现出乳酰基转移酶活性,催化α-微管蛋白发生乳酰化修饰。研究通过在细胞中分别敲除HDAC6和乙酰基转移酶MEC-17,发现了HDAC6是细胞内微管蛋白最主要的乳酰基转移酶。体外实验进一步证实了HDAC6能够直接利用乳酸作为乳酰基供体,促进α-微管蛋白的乳酰化。
细胞中的微管处于不断聚合和解聚的动态平衡中。本研究发现,α-微管蛋白乳酰化修饰主要存在于解聚的微管蛋白中,而同一位点的α-微管蛋白乙酰化修饰则存在于聚合的微管中。有意思的是,α-微管蛋白的乳酰化修饰能够增强微管的动态性,促进发育过程中神经元突起的生长以及神经元轴突损伤后的再生过程。
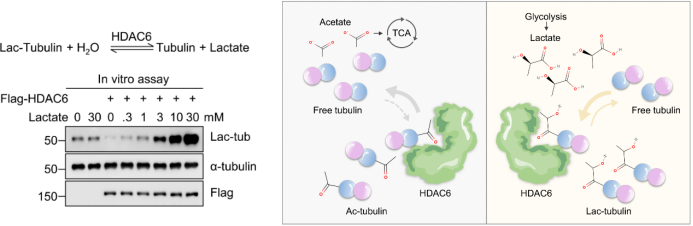
图1. HDAC6利用乳酸催化α-微管蛋白乳酰化反应
本研究发现了HDAC6作为乳酰基转移酶的新功能,揭示了细胞代谢状态的改变可以通过HDAC家族成员调控微管蛋白的乳酰化修饰水平,从而调节微管的动态不稳定性的分子机制。这一发现为理解代谢变化调控细胞骨架功能,及其在神经系统发育和神经退行性疾病过程中的作用提供了新的思路。
本文第一作者为上海科技大学李磊课题组博士毕业生孙双双和博士研究生徐哲,上海科技大学李磊为通讯作者,上海科技大学为第一完成单位和通讯单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号