近日,上海科技大学生命科学与技术学院孙博课题组在学术期刊《核酸研究》(Nucleic Acids Research)发表了题为“CRISPR-AsCas12f1 couples out-of-protospacer DNA unwinding with exonuclease activity in the sequential target cleavage”(CRISPR-AsCas12f1结合原间隔外DNA的解旋以及外切酶活性实现对靶DNA的顺序切割)的研究论文,揭示了紧凑型CRISPR核酸酶AsCas12f1的独特核酸酶切割活性。
CRISPR-Cas系统是细菌和古菌在长期演化过程中形成的用以对抗入侵病毒及外源DNA的免疫防御系统。II类CRISPR系统中的Cas蛋白因其组成简单、成本低廉等特点,已被广泛开发成多种基因编辑工具。然而,较为常用的Cas9与Cas12a等CRISPR核酸酶通常具有较大的分子量(大于1,000个氨基酸),不利于体内递送,严重限制了其应用。II类V-F型CRISPR-Cas12f蛋白作为一类新近发现的紧凑型Cas核酸酶(约400-700个氨基酸),较小的分子量极大方便了其作为基因编辑系统的体内递送。其中,来自细菌Acidibacillus sulfuroxidans中的AsCas12f1(422个氨基酸)对靶DNA的切割模式不同于其它Cas核酸酶,其准确的分子机制仍不清楚。
该工作系统研究了AsCas12f1及其改进型突变体对靶DNA切割过程的动力学分子机制。研究发现,AsCas12f1解旋原间隔区内DNA后,在非靶链DNA上产生缺口(nick)并进行双向外切模式的核酸降解;随后,AsCas12f1把DNA解旋范围扩展到原间隔区外的5-bp DNA,并对解旋的DNA进行顺序降解;最后,AsCas12f1在原间隔区下游3个核苷酸处内切靶链DNA,并对PAM远端DNA进行释放,在靶DNA位置生成三处断裂位点(图1)。对比实验表明Mg2+有助于原间隔内、外DNA的解旋和降解之间的耦合,AsCas12f1-v5.1蛋白的突变加速了原间隔序列DNA的切割。综上,该工作确定了AsCas12f1对靶DNA切割过程中的独特双向核酸外切酶活性,提供了完整的AsCas12f1催化DNA解旋偶联核酸降解的动态视图,为基于Cas12f基因编辑工具的开发、设计以及改进提供了重要参考。
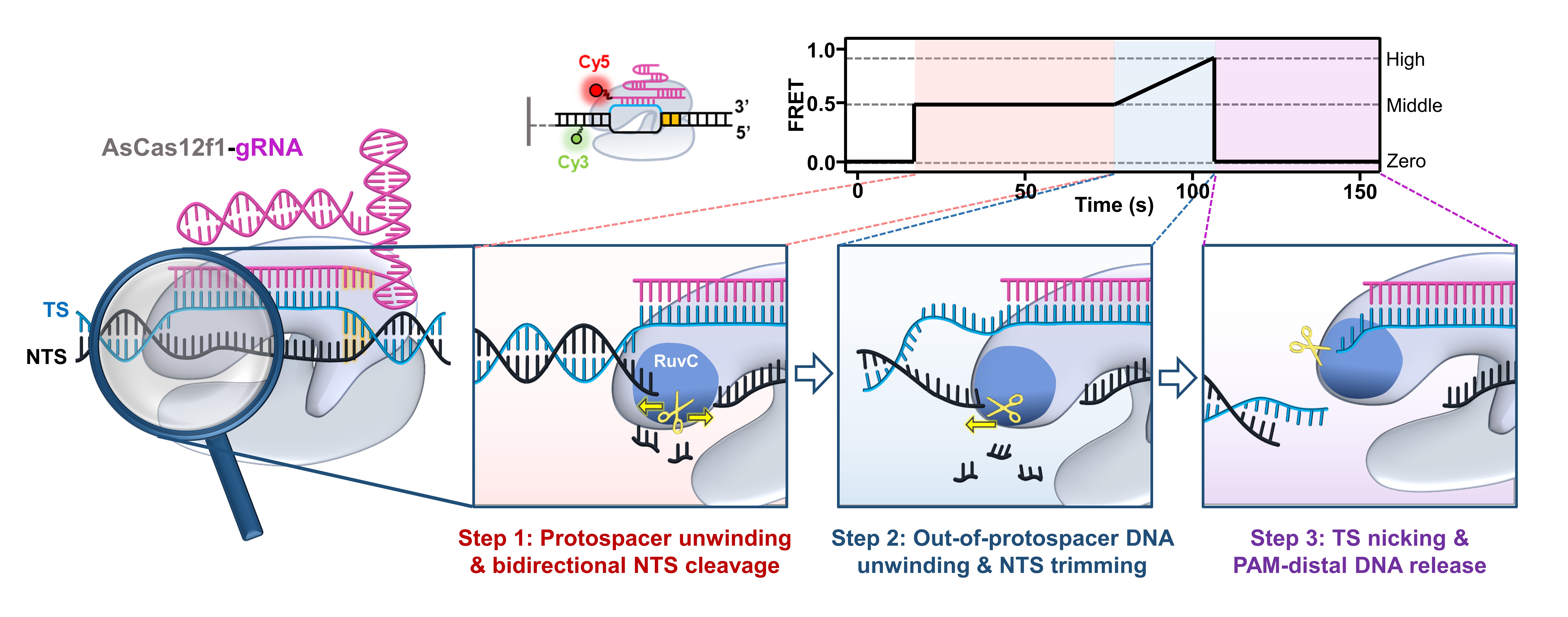
图1:AsCas12f1催化DNA靶序列顺序切割的分子机制模型。
上科大生命学院2023级博士生宋晓萱及2023届博士毕业生陈紫婷为该论文的共同第一作者,孙博教授为通讯作者。上海科技大学为第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号