近日,上海科技大学生命科学与技术学院盖景鹏课题组与中国科学院上海有机化学研究所生物与化学交叉研究中心于杰课题组在《细胞发现》(Cell Discovery) 发表了题为“Structural basis for catalytic mechanism of human phosphatidylserine synthase 1”的研究论文。该研究通过冷冻电镜技术解析了磷脂酰丝氨酸合酶 1(PSS1)在无底物结合状态、与钙离子结合状态,以及与钙离子和丝氨酸结合状态下的三维结构,揭示了磷脂酰丝氨酸合酶1的催化合成机制,为Lenz-Majewski综合症的致病机制研究和治疗策略的开发提供了新的方向。
磷脂酰丝氨酸(PS)是细胞膜的重要组分和信号分子,在众多细胞过程中起着关键作用,如细胞凋亡、病毒内化和胆固醇运输。在哺乳动物中,PS的从头合成由两种内质网跨膜酶介导:磷脂酰丝氨酸合成酶1 (PSS1)和磷脂酰丝氨酸合成酶2 (PSS2)。这些酶通过钙依赖性的碱基交换反应催化L-丝氨酸取代磷脂酰胆碱(PC)或磷脂酰乙醇胺(PE)的头基,最终合成PS。PSS1的功能获得性突变可能导致PS的过度合成,从而引发一种罕见的遗传性疾病Lenz-Majewski综合症(LMS)。患者通常表现为严重的智力发育迟滞、畸形、骨骼异常及其他多个器官和系统的损害。目前,LMS尚无有效治疗方法。因此,深入阐明PSS1的催化机制,对于治疗该疾病至关重要。
本文解析了以二聚体形式存在的PSS1结构,并揭示了其催化机制。研究发现每个PSS1单体内均结合有八个内源性脂质分子,包括五个磷脂酰胆碱或磷脂酰乙醇胺、两个磷脂酰丝氨酸,以及一个磷脂酰肌醇(PI)(图1)。PSS1的核心结构域位于内质网一侧,是催化活性中心所在。在催化反应过程中,钙离子与带负电荷的口袋结合,稳定了催化核心结构。而催化残基H172通过与L-丝氨酸和磷脂酰胆碱相互作用,促进了碱基交换反应,从而生成磷脂酰丝氨酸(图2)。
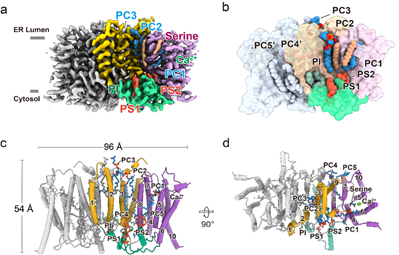
图1 PSS1的整体结构
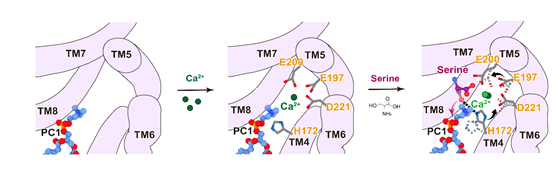
图2 PSS1的催化机制
盖景鹏课题组长期致力于罕见遗传病相关膜蛋白的分子机制研究。这项研究是继阐明神经性溶酶体贮积病(LSD)致病基因HGSNAT的分子机理之后,再度取得的重要进展。本次研究为罕见病领域的研究提供了新动力,也为开发治疗相关疾病的药物奠定了坚实基础。
上海科技大学博士研究生宁莹洁、中国科学院生物与化学交叉研究中心博士研究生徐睿声为本文共同第一作者;盖景鹏、于杰为本文共同通讯作者,上海科技大学为第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号