G蛋白偶联受体(G protein-coupled receptor, GPCR)的翻译后修饰是细胞精细调控受体结构和功能的重要机制之一。多种动态可逆的翻译后修饰能影响受体的蛋白质合成、转运、激活、内吞等过程,从而调控细胞信号转导及相关生理功能。尽管近年来GPCR结构药理学的研究取得了显著进展,但对于不同类型翻译后修饰如何特异地调控GPCR结构与活性的理解存在明显不足。
近日,上海科技大学iHuman研究所、生命科学与技术学院水雯箐课题组与复旦大学鲁伯埙团队合作,在国际学术期刊《自然-化学生物学》(Nature Chemical Biology)上发表了题为”Post-translational modifications orchestrate the intrinsic signaling bias of GPR52”的研究论文。该工作系统探究了神经退行性疾病的潜在靶点GPR52,全面鉴定了其N-糖基化与磷酸化修饰模式,揭示了位点特异的翻译后修饰如何调节受体特殊的自激活构象、下游多条信号通路以及受体依赖的亨廷顿病理蛋白累积。
GPR52是一种在大脑纹状体中高度表达的孤儿受体,被认为是亨廷顿疾病和精神分裂症等疾病的潜在药物靶点。GPR52具有极高的G蛋白通路组成性活性,徐菲课题组的前期研究表明,受体的第二胞外环可作为内置激动剂占据正构口袋,促使受体发生自激活。本工作发现,相较于G蛋白通路的高组成性活性, GPR52在另一条β-arrestin通路上的组成性活性及激动剂诱导活性均明显降低,显示出不同于其他GPCR的内在信号转导偏向性(intrinsic signaling bias)。
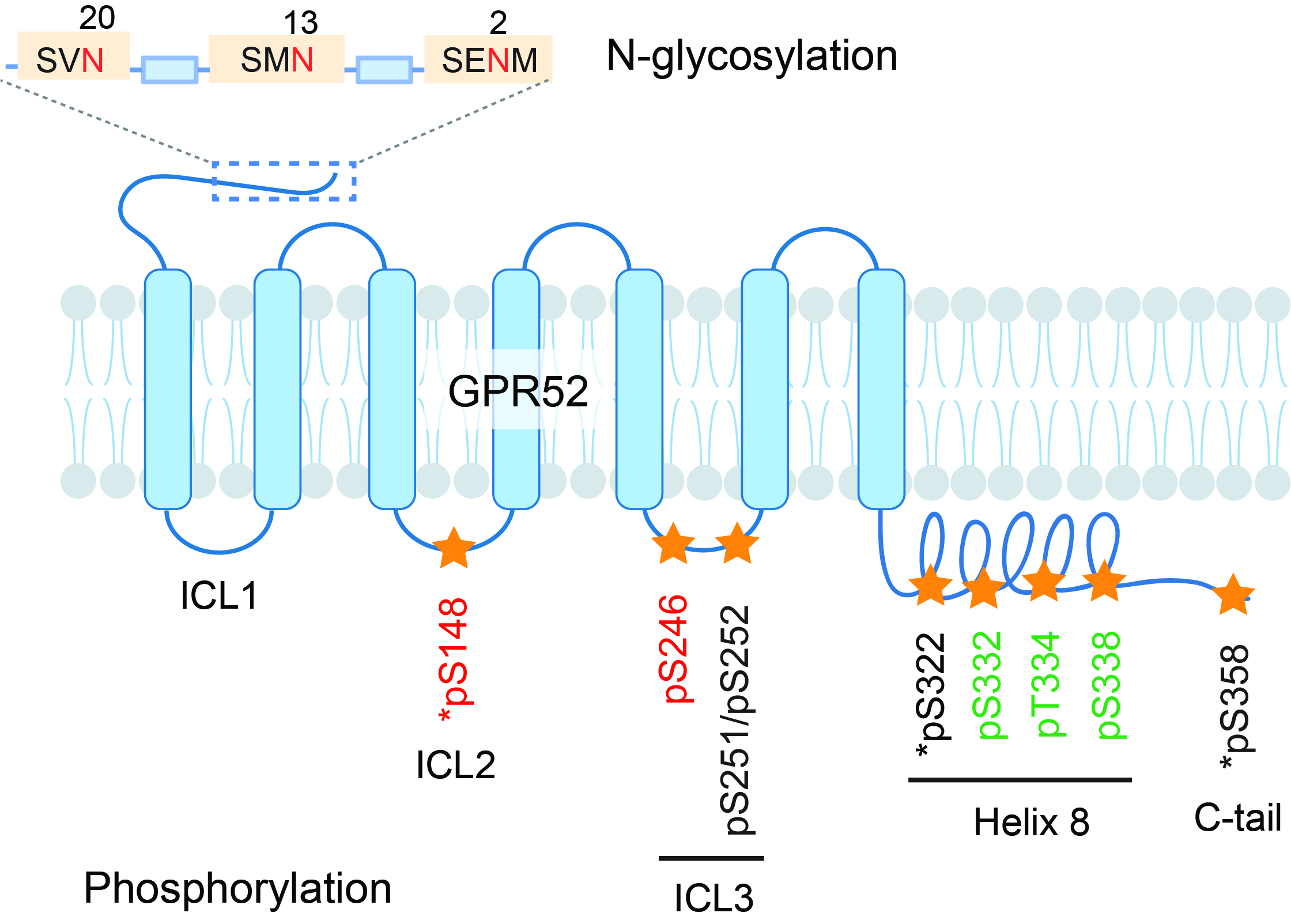
图1 GPR52 N-糖基化和磷酸化修饰位点分布
为探究GPR52内在信号转导偏向性的分子机制,利用修饰质谱技术对GPR52蛋白的翻译后修饰进行系统性分析(图1):在受体N端鉴定3个N-糖基化位点,在多个胞内环、第8螺旋(helix 8)和C端共鉴定9个磷酸化位点;进而发现特定位点的修饰水平随激动剂的刺激而发生改变。结构质谱和药理学实验结果表明,N端20位N-糖基化可能通过调节第二胞外环的构象促进GPR52自激活构象的形成,进而影响受体介导的G蛋白通路活性。另一方面,对磷酸化模式的研究显示,与传统认知相反,helix 8上的磷酸化具有自抑制功能,能够抑制受体对β-arrestin2的招募并使受体的内吞受阻。因此,本工作提出一个模型:helix 8的高本底磷酸化抑制了GPR52偶联β-arrestin2活性,使受体难以自发脱敏和内吞,可持续引发G蛋白通路信号,而受体的N-糖基化能进一步提高G蛋白通路活性,从而产生内在信号转导偏向性(图2)。研究还在亨廷顿病的细胞模型中揭示,N-糖基化和磷酸化修饰对亨廷顿病理蛋白的累积起到相反作用,这为深入理解疾病机制提供了新的切入点。
综上所述,本工作揭示了不同类型翻译后修饰对GPR52的独特结构特征与内在信号转导偏向性的精确调控机制,为深入理解GPCR的激活、信号传导及其生理功能的分子基础提供了新的研究视角与见解。
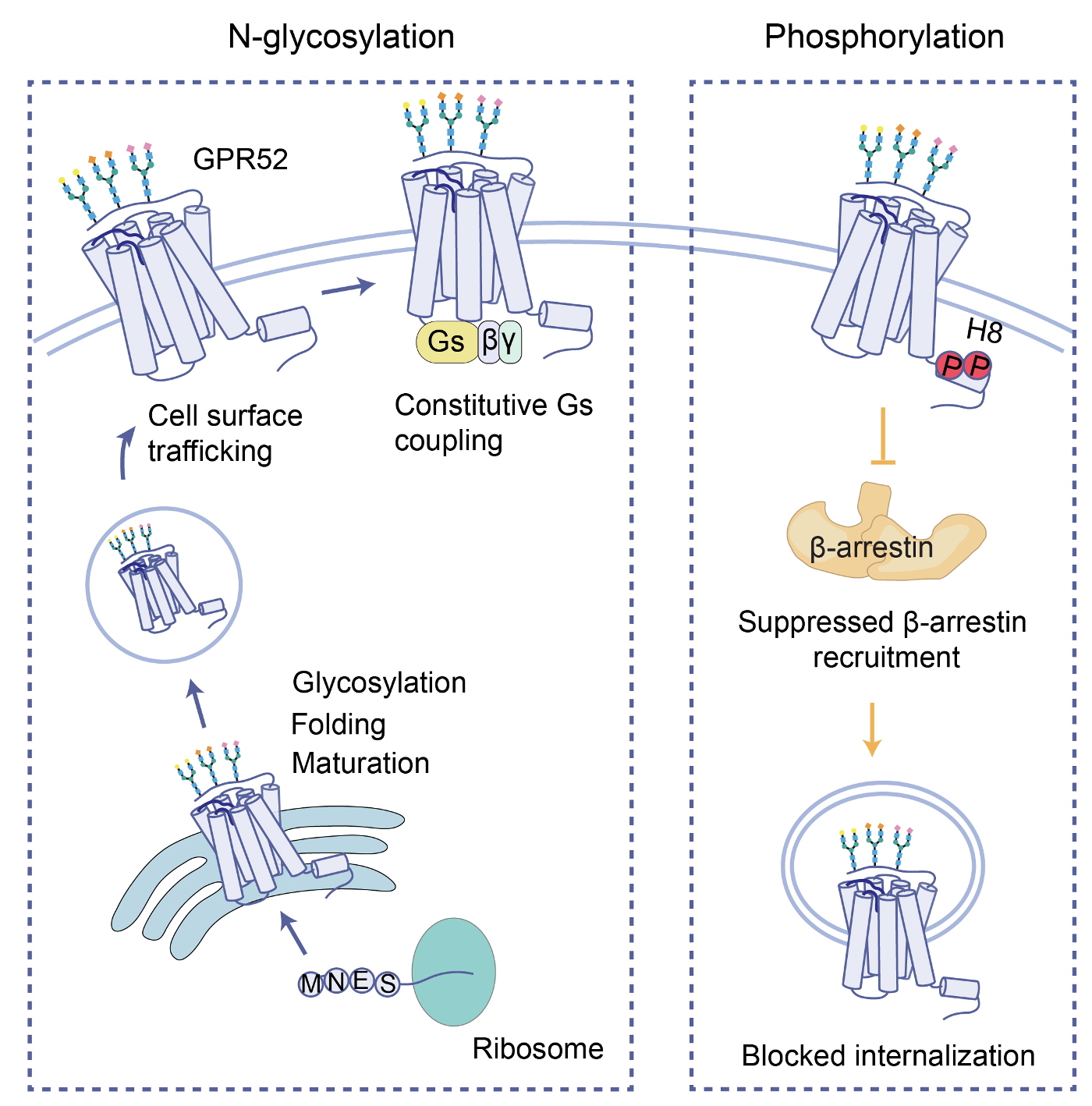
图2 N-糖基化与磷酸化协同调控GPR52内在信号转导偏向性的模型
上海科技大学iHuman研究所副研究员张冰洁为论文第一作者,生命科学与技术学院2024级博士研究生葛巍、iHuman研究所博士后马孟纳也为论文作出重要贡献。iHuman研究所研究员、生命学院常任副教授水雯箐与复旦大学生命科学学院鲁伯埙教授为该论文的共同通讯作者。该工作得到了iHuman研究所徐菲教授以及国家蛋白质科学研究(上海)设施、上海临床研究中心曾嵘教授的帮助。上海科技大学为第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号