近日,上海科技大学生命科学与技术学院胡霁课题组与上海交通大学医学院附属瑞金医院神经内科陈晟课题组在神经病学期刊《脑》(Brain)在线发表了题为“Parvalbumin neurons mediate neurological phenotypes of anti-NMDAR encephalitis”的研究论文,首次揭示了小清蛋白(Parvalbumin,PV)阳性中间神经元介导抗NMDAR脑炎认知障碍的神经环路机制,这一发现为抗NMDAR脑炎的治疗提供了新的潜在靶点。

自身免疫性脑炎(autoimmune encephalitis, AE)的概念源于对传统“病毒性脑炎”的重新认知。20世纪60年代,学者发现部分脑炎患者对免疫治疗敏感,但机制未明。2007年,何塞普·达尔莫(Josep Dalmau)团队在Annals of Neurology杂志上首次报道了一组年轻女性患者出现精神症状、癫痫发作和卵巢畸胎瘤,这些患者的脑脊液中检测到抗NMDAR抗体,命名为抗NMDAR抗体脑炎。这一发现成为AE研究的里程碑,标志着AE作为一个独立疾病实体的正式确认。但AE的免疫与神经环路机制尚不完全清楚,为精准诊疗带来挑战。
为了进一步探索抗NMDAR抗体作为“责任抗体”导致神经系统损伤的机制,本研究建立了抗NMDAR抗体脑炎的被动免疫模型。本研究将患者来源的anti-NMDAR IgG注入小鼠内侧前额叶皮层(mPFC)连续7天,小鼠会出现类似临床的认知障碍症状。实验结果显示,anti-NMDAR IgG特异性损伤mPFC的小清蛋白阳性(Parvalbumin+,PV+)神经元,导致其细胞形态损伤、兴奋性降低、突触传递功能减弱,以及低伽马波段神经振荡异常。通过光遗传学和药物遗传学技术激活mPFC PV神经元,anti-NMDAR IgG诱导的认知障碍可以被逆转。值得注意的是,本研究在海马体中也观察到类似mPFC PV神经元的变化,表明anti-NMDAR IgG对PV神经元的影响具有广泛性。
当前对AE的神经致病机制的理解仍面临诸多挑战和复杂性,本研究从神经环路的视角首次阐明了PV+神经元在抗NMDAR脑炎相关认知障碍中的关键作用,为未来进一步探索AE的神经生物学机制及精准干预奠定了新的理论基础。
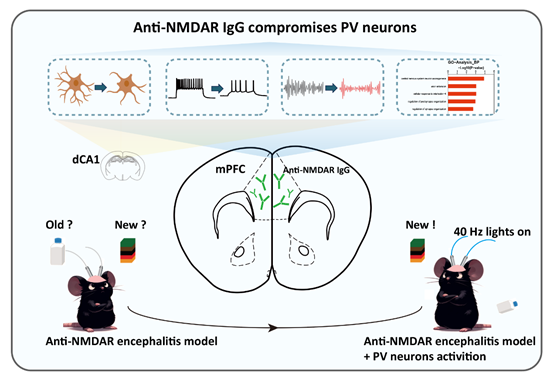
图1 PV神经元调节抗NMDAR脑炎抗体导致认知障碍示意图
该论文的第一作者为上海科技大学生命学院博士后封一帆,他是上科大首届本科生,本科毕业后一直在胡霁课题组进行硕博学习和博士后训练。生命学院2023届硕士毕业生曾子珂及上海交通大学医学院硕士毕业生倪优为该论文的共同第一作者。上海科技大学生命学院胡霁教授、上海交通大学医学院附属瑞金医院神经内科陈晟教授、上海科技大学生命学院朱晓娜副研究员为共同通讯作者。上海科技大学为第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号