近日,上海科技大学生命科学与技术学院李剑峰课题组和陈佳课题组合作,在国际学术期刊《ACS 纳米》 (ACS Nano)发表了题为“Targeted Delivery of mRNA with Polymer-Lipid Nanoparticles for In Vivo Base Editing”的研究论文,报道了一类新型核酸递送系统聚合物-脂质纳米颗粒(Polymer-lipid nanoparticles, PLNPs),成功将碱基编辑器ABE8e递送至肝脏,实现高效的心血管疾病相关风险基因Pcsk9和Angptl3的碱基编辑和协同降血脂功效,编辑效率处于国际领先水平。

碱基编辑器作为CRISPR/Cas基因编辑技术的重要衍生工具,因其独特的编辑机制——无需诱导DNA双链断裂且不依赖外源DNA模板,已成为治疗遗传性疾病的新型技术手段。在杂合家族性高胆固醇血症、地中海贫血、急性T淋巴细胞白血病及慢性肉芽肿病等疾病的治疗领域展现出广阔的应用前景。然而,如何在实现碱基编辑器精准器官靶向递送的同时,兼顾生物相容性和递送稳定性,是亟待解决的关键问题。
针对这一技术瓶颈,本研究构建了一类具有不同亲疏水性骨架、100%疏水侧链、不同胺类(单胺或双胺)封端的新型聚β氨基酯材料库,并与其他辅料如胆固醇、辅助脂质和聚乙二醇脂质等组合形成聚合物-脂质纳米颗粒(Polymer-lipid nanoparticles, PLNPs)。研究发现,eLogP值可作为预测PLNP肝、肺靶向性的重要参数,即eLogP值越大,越倾向于肝脏表达,eLogP值越小,越倾向于肺表达,这一发现为此类材料的后续优化提供了新的理论依据。本研究进一步基于构效关系扩展了聚β氨基酯库,筛选得到PLNP(7C8C8),其体内递送效率优于商业化产品ALC-0315、SM102和Dlin-MC3-DMA。此外,其具有优异的生物相容性,显示出在蛋白替代疗法方面应用的巨大潜力。另外,PLNP经冻干处理后展现出优异的稳定性,在4°C储存条件下其生物发光效果可维持至少60天。体内实验证实,PLNP可以在低至0.2 或0.75 mg/kg的总RNA剂量下实现约70%的Pcsk9或Angptl3基因编辑效率,而相应蛋白水平更可降低90%以上,且双靶点协同作用可使低密度脂蛋白胆固醇(LDL-C)水平降低60%。
综上,该研究构建了一类高效、特异、安全、稳定的体内碱基编辑器递送系统,为相关疾病的基因治疗提供新的方案。
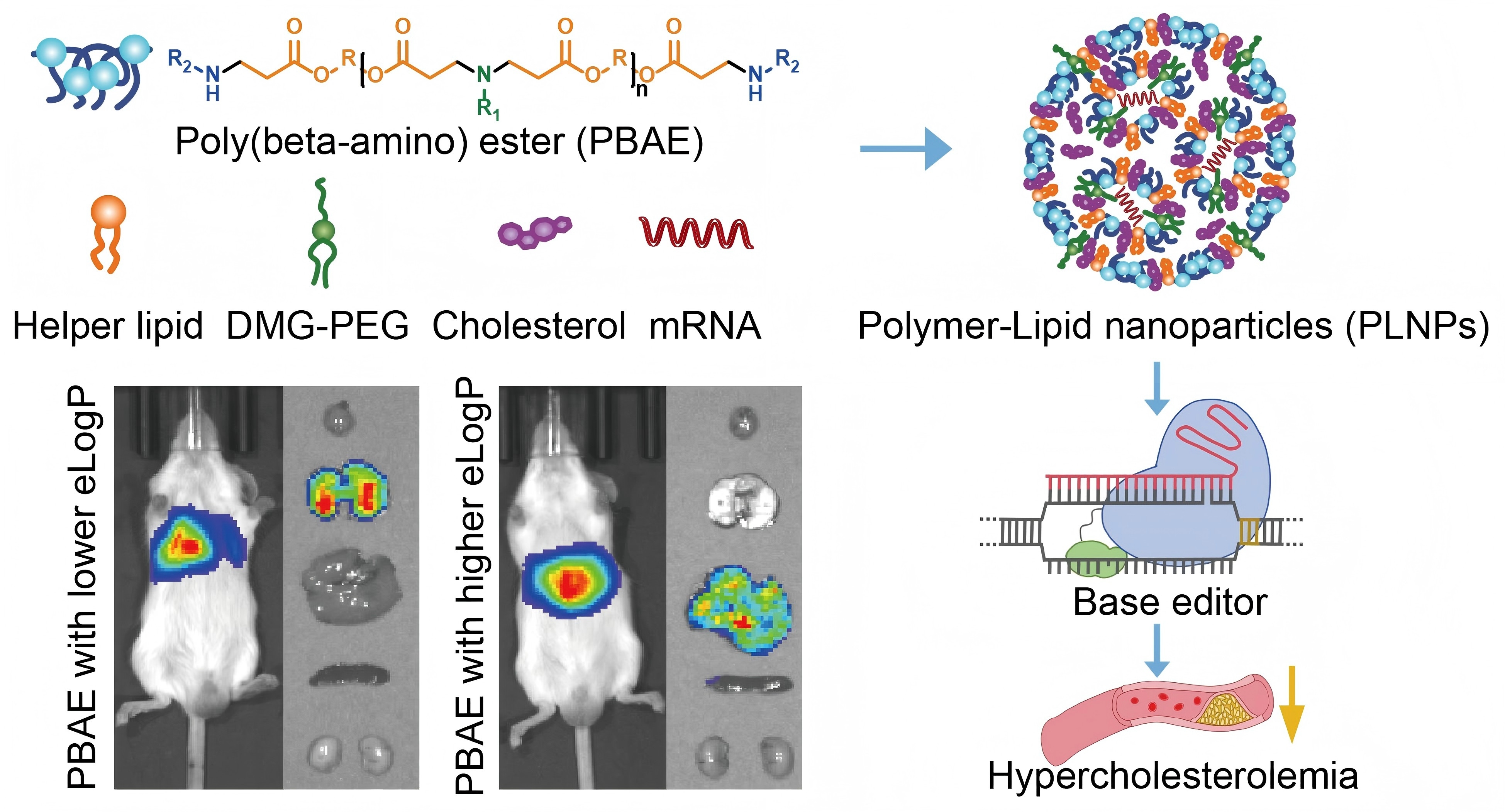
图:聚合物-脂质纳米颗粒构建示意图及其在碱基编辑器递送中的应用。
本文第一作者为上海科技大学李剑峰课题组博士生陈启明星和硕士生常艳,李剑峰教授与陈佳教授为共同通讯作者,上海科技大学为第一完成单位和通讯单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号