近日,上海科技大学生命科学与技术学院陈佳团队在《自然-生物技术》(Nature Biotechnology)期刊在线发表了题为“Leveraging base excision repair for efficient adenine base editing of mitochondrial DNA ”的研究论文,揭示了线粒体DNA腺嘌呤碱基编辑器TALEDs的工作机制,并研发出一系列增强型工具(eTALED6s),显著提升了编辑效率与精准度,为线粒体疾病治疗提供了新工具。
线粒体作为细胞的“能量工厂”,在产生三磷酸腺苷(ATP)中起着至关重要的作用。线粒体拥有自己独立的DNA(线粒体DNA,mtDNA),它编码线粒体功能所需的特定基因。与核DNA相比,由于在氧化磷酸化过程中会产生大量的活性氧,mtDNA更容易发生突变。其中大多数突变都是碱基替换,会导致各种线粒体遗传性疾病,如Leber遗传性视神经病变(LHON)、Leigh综合征和线粒体脑肌病、乳酸酸中毒和中风样发作(MELAS)等。
在已知疾病相关的碱基替换中,超过40%是G-to-A/C-to-T突变,可通过A-to-G碱基编辑恢复。尽管基于CRISPR的碱基编辑系统已被广泛用于核基因组DNA中,但由于引导RNA(gRNA)难以递送至线粒体,尚未有效应用于mtDNA中。近期,转录激活因子样效应物(TALE)连接的脱氨酶(TALEDs)被报道,包括TALE阵列、双链DNA(dsDNA)特异性胞苷脱氨酶(DddA)和单链DNA特异性腺苷脱氨酶(TadA8e)。与mtDNA中DddA介导的C-to-T编辑不同,TALEDs实现A-to-G编辑的详细机制尚未完全清楚。
本研究构建了多个BER相关基因的敲除细胞株,结合体外脱氨实验发现TALEDs并非直接在双链DNA上进行A-to-G编辑,而是依赖DddA诱导C-to-U的脱氨反应,触发线粒体碱基切除修复(BER)过程。TALED中的DddA首先介导了C-to-U的脱氨,体内的尿嘧啶糖苷酶会进一步切除所产生的尿嘧啶(U),形成碱基缺乏(AP)位点,含有AP位点的DNA单链被APE1催化切割或自发断裂,产生DNA单链断裂(SSB)。SSB被核酸外切酶hMGME1进一步加工形成单链DNA(ssDNA),TALED中的TadA8e以ssDNA为底物介导A-to-I的脱氨反应,并在随后的修复过程中完成A-to-G的编辑(图1)。
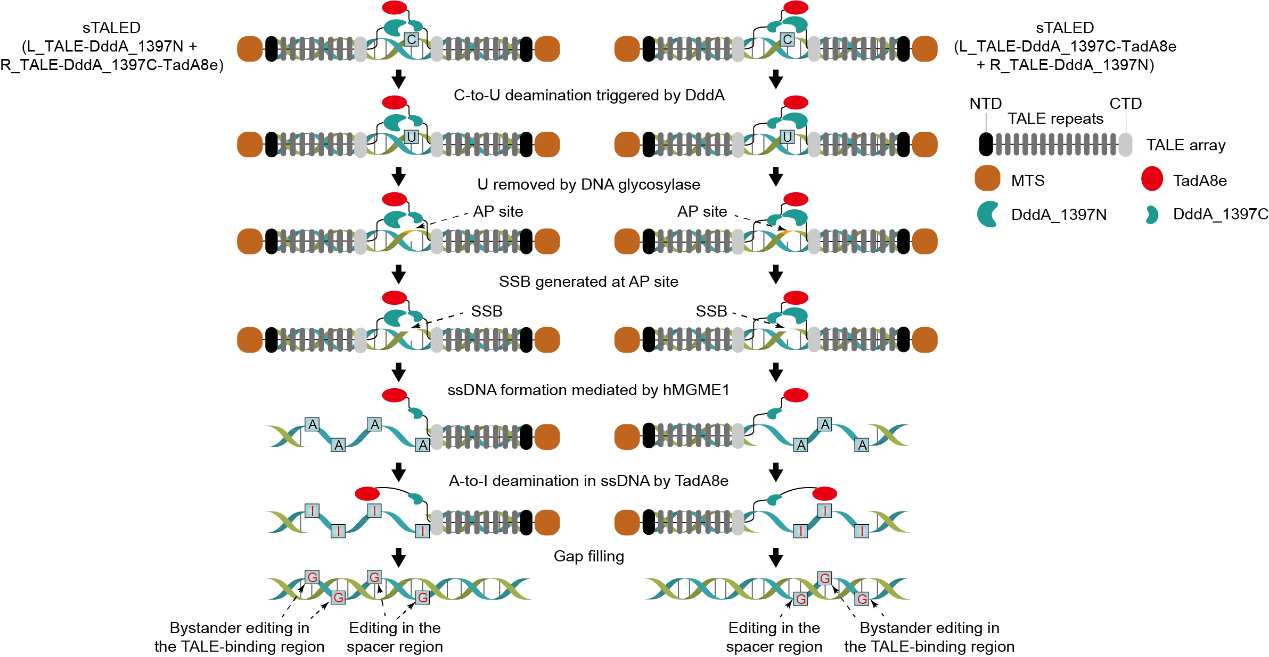
图1:TALED工作机制示意图
本研究利用BER开发了一系列增强型TALEDs (eTALED6s),显著提高了TALEDs在靶向位点处的编辑效率。通过对腺嘌呤脱氨酶TadA8e进行工程化改造,使得TALEDs在转录组水平上的脱靶突变显著降低,同时还缩小了编辑窗口,减少了旁观者效应,显著提高了编辑产物纯度。研究还使用esTALED6和工程化的esTALED6R在线粒体基因组中模拟了与Leigh综合征和MELAS相关的致病突变m.A13514G(图2),通过测量氧耗率(OCR),证实eTALEDs成功诱导了预期的线粒体功能异常。
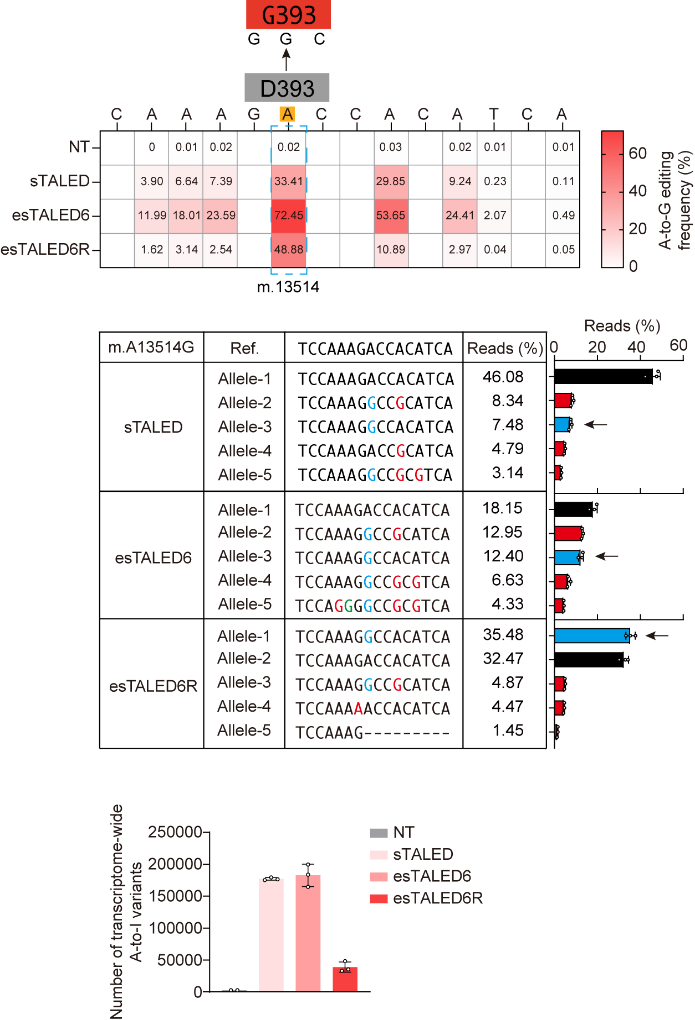
图2:sTALED、esTALED6和esTALED6R和在线粒体基因组m.13514位点处介导的编辑效率(上),编辑产物纯度(中)以及转录组脱靶数量(下)
这项研究不仅填补了TALED分子机制研究的空白,还在分子机制研究的基础上进一步构建了一系列精准、高效、低脱靶的新型线粒体腺嘌呤碱基编辑工具,使其在线粒体疾病模型构建、遗传修复和相关基础研究中具有广泛的应用前景。
上海科技大学陈佳教授为该论文通讯作者。上海科技大学陈佳课题组博士研究生樊煜航、许文超,中国科学院上海营养与健康研究所博士研究生高宝青为该论文共同第一作者。上海科技大学为论文的第一完成单位。该工作得到了复旦大学生物医学研究院杨力研究员的大力支持。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号