近日,上海科技大学iHuman研究所、生命科学与技术学院华甜课题组与生命学院沈伟课题组合作在国际学术期刊《细胞报告》(Cell Reports)上发表了题为“Structural basis of oligomerization-modulated activation and autoinhibition of orphan receptor GPR3”的研究论文。该研究通过冷冻电镜技术解析了GPR3在单体、二聚体状态下与G蛋白复合物的三维结构,以及GPR3非激活态的二聚体结构,首次揭示二聚化调控的受体激活和自抑制的独特分子机制,为靶向GPR3的阿尔茨海默症(Alzheimer's disease,AD)和脂肪代谢相关疾病的药物开发提供了全新视角。
GPR3是class A家族孤儿受体,因其在Gs信号通路中具有高本底活性而备受关注。研究表明,GPR3在阿尔茨海默症中通过促进淀粉样蛋白(Aβ)的生成参与调控病理进程,在脂肪细胞产热过程中也发挥重要作用。然而,其高本底活性及细胞信号调控的分子机制仍存争议。
研究团队通过单颗粒冷冻电镜技术解析了GPR3在不同状态的复合物结构,首次捕捉到其单体与二聚体共存的状态(图1)。结果显示,GPR3二聚体通过跨膜螺旋5(TM5)形成广泛的二聚体界面,其结合界面面积远超其它class A GPCR二聚体结构(如APJR)。进一步分析表明,在二聚体中,仅一个受体与G蛋白结合,另一个受体则通过胞内环ICL3的构象变化阻碍G蛋白结合,揭示了“二聚化介导自抑制”的新机制。此外,研究者还在GPR3的正构口袋中观察到长管状电子密度,提示脂质分子可能作为内源性配体调节其活性。
该研究不仅揭示了GPR3的激活与自抑制机制,还通过细胞水平实验验证了二聚体在生理状态下的存在,为阐明孤儿受体信号转导动态调控提供了理论基础。基于结构的突变实验进一步验证了关键残基在二聚体界面形成和信号传递中的功能,为开发靶向GPR3的激动剂或抑制剂奠定了结构基础,未来或可通过调控GPR3寡聚状态干预AD进程或脂肪代谢。
GPR3与GPR6、GPR12同属一类受体,均与内源性大麻素受体(CB1/CB2)高度同源。此前研究多关注其单体形式,此次发现的二聚化功能为孤儿受体信号调控的多样性提供了重要补充。这也是华甜课题组对潜在内源性大麻素系统相关孤儿受体的系列研究中的又一突破。
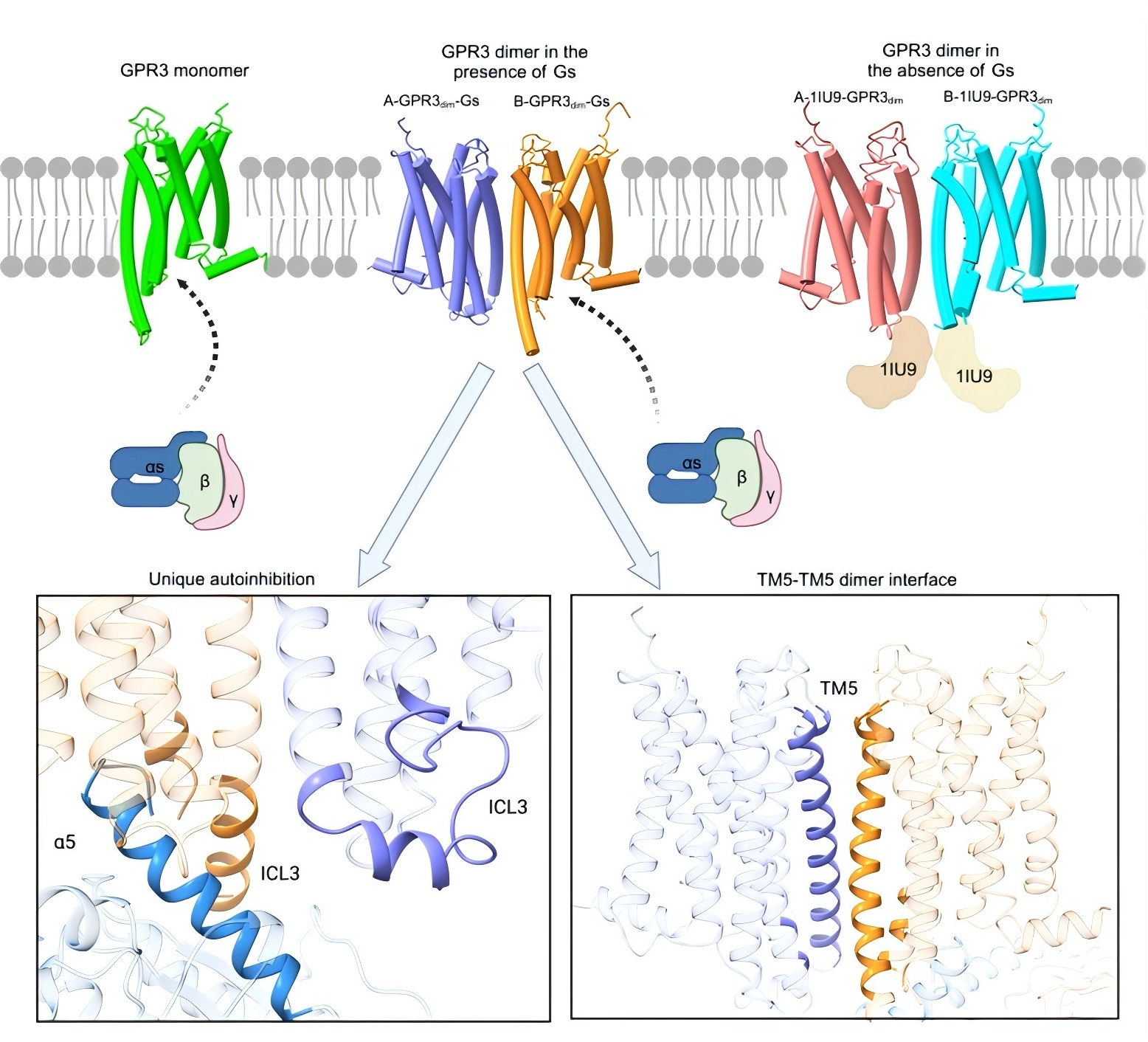
图1. GPR3的二聚化和自抑制分子机制展示图
上海科技大学iHuman研究所、生命科学与技术学院2022级博士研究生常浩和iHuman研究所副研究员李潇婷为共同第一作者,上海科技大学生命学院常任副教授沈伟和iHuman研究所研究员、生命学院助理教授华甜为共同通讯作者。该工作得到上科大生物电镜平台和其他平台的支持,上海科技大学为第一完成单位。
论文链接:https://www.sciencedirect.com/science/article/pii/S2211124725002499?via%3Dihub


 沪公网安备 31011502006855号
沪公网安备 31011502006855号