近日,上海科技大学iHuman研究所刘志杰/华甜课题组与合作者在国际学术期刊《细胞研究》(Cell Research)上发表了题为“Structural basis of stepwise proton sensing-mediated GPCR activation”的研究论文,揭示了质子感应G蛋白偶联受体(Proton-sensing GPCRs)GPR4和GPR65的结构基础及独特的分步激活机制。这一发现不仅深化了对pH感应GPCR的理解,还为开发针对炎症性疾病、癌症等pH相关疾病的靶向治疗提供了新思路。
GPCRs是人体内最大的膜蛋白家族,广泛参与跨细胞膜生理信号传递,约40%的上市药物以其为靶点。pH感应GPCRs在细胞微环境感知和信号转导中发挥关键作用。其中,GPR4、GPR65、GPR68等受体能够直接感知细胞外质子浓度变化,在维持人体酸碱平衡、调控免疫反应、影响肿瘤微环境等方面发挥关键作用。目前对此类受体的质子感知及激活机制仍存在争议,有必要进行深入和全面的结构与功能分析。
研究团队利用单颗粒冷冻电镜技术解析了在pH6.0至8.0范围内,GPR4和GPR65与G蛋白(Gs、Gq、G13)形成的复合物结构(图1)。通过对比不同pH条件下拮抗态与激活态受体分子的结构差异,完整描绘了质子驱动的动态激活轨迹。他们还意外捕捉到了GPR4受体“部分激活”的中间态,进而提出了该受体分步激活的理论模型,丰富了GPCR激活过程的多样性。本研究揭示了组氨酸-羧酸网络构成的“质子传感器”,在GPR4的胞外结构域中,组氨酸H269和H165与周围的羧酸残基形成精密网络,当pH降低时,这些组氨酸被质子化,触发氢键重构。这种网络如同“分子开关”,驱动胞外环ECL2从水平短环(非活性态)转变为垂直β-sheet结构(活性态)(动画)。同时,GPR4能够偶联Gs、Gq、G13等多种G蛋白,但具体机制仍待进一步探究。本次解析的GPR4 与三种不同G蛋白的复合物结构揭示了同一受体通过细微构象变化调控不同信号通路的机制,为开发信号通路特异性药物奠定了重要基础。
此外,本研究还解析了GPR4与拮抗剂NE52-QQ57的复合物结构。该小分子并非占据传统正构口袋,而是结合在由跨膜螺旋TM2、TM3和TM7形成的变构位点,迫使ECL2构象“冻结”在非活性状态,从而阻断质子感应网络。这一发现为设计高选择性拮抗剂提供了全新思路。
该工作首次系统解析了GPR4和GPR65在不同pH条件下的构象变化及激活机制,为理解质子感知受体如何介导信号传递提供了关键的结构基础,有助于更多小分子调节剂的发现,提供精准干预pH感应GPCR的活性,从而为炎症、肿瘤等相关疾病的治疗带来新的策略。
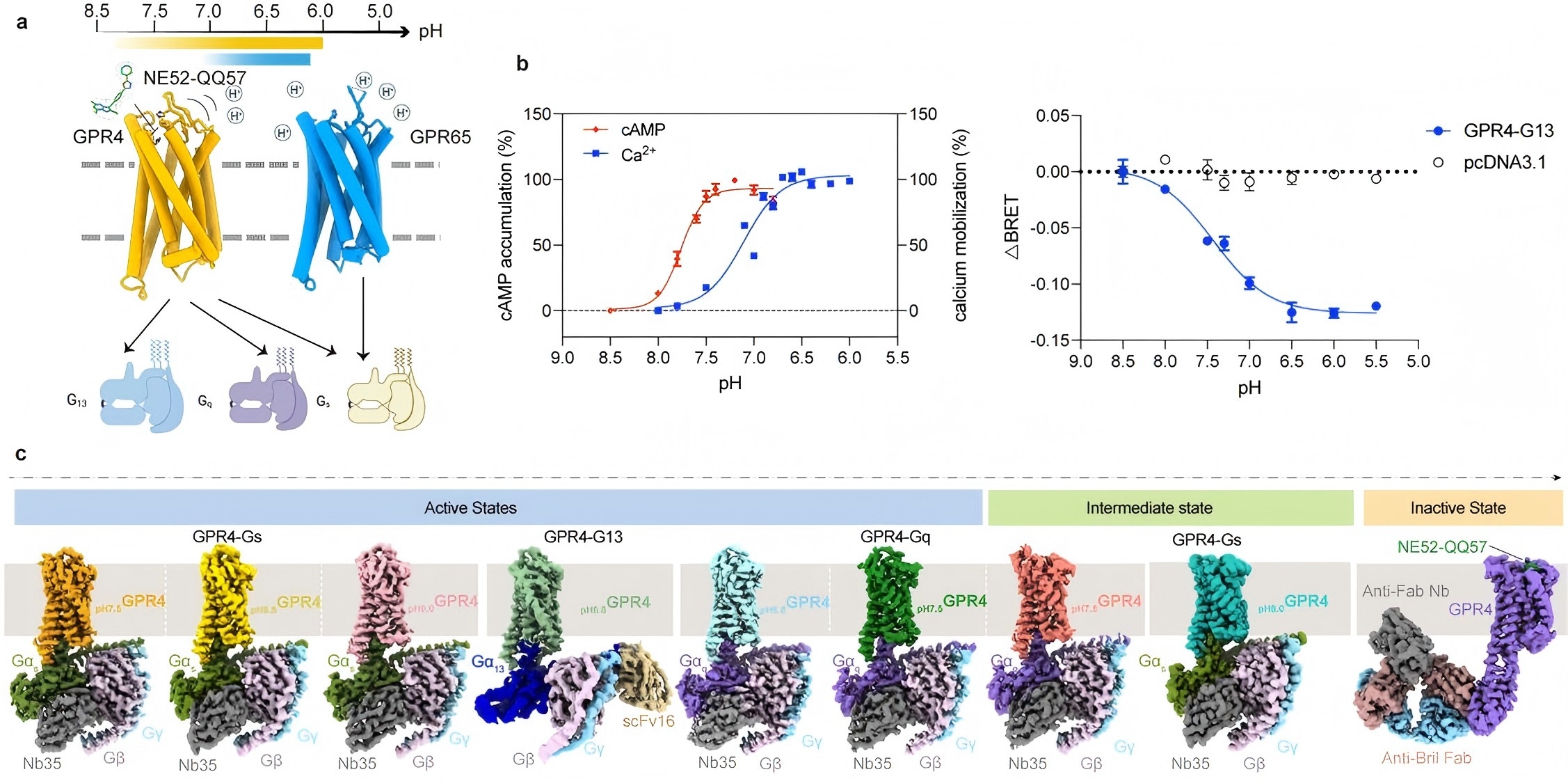
图1 GPR4和GPR65激活的分子机制
动画GPR4的ECL区域的动态变化
上海科技大学iHuman研究所、生命科学与技术学院2023级博士研究生岳晓磊、2022级博士研究生彭立和刘沈徽为共同第一作者;上海科技大学iHuman研究所副研究员武丽杰、海军军医大学附属长征医院教授徐沪济和上海科技大学iHuman研究所研究员、生命科学与技术学院教授刘志杰,助理教授华甜为该工作的共同通讯作者。该工作得到上科大生物电镜平台和其他平台的支持,上海科技大学为第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号