四年前的同一天,中国、韩国、美国三个科研团队不约而同地发表了类似的科研成果——Cas12f基因编辑器。但由于韩国团队抢先申请了专利,拔得头筹,因而获得融资。
三年后,上海科技大学孵化企业“篆码生物”另辟蹊径,凭借拥有自主知识产权的Cas12n微型基因编辑器,填补了我国在基因编辑底层技术领域的空白。
如今,在上科大支持下,“篆码生物”的Cas12n获得专利独家许可进行产业转化,开发针对遗传病和慢性病的体内基因治疗管线,有望为患者提供“一次给药,终身治愈”的基因疗法。目前,Cas12n的专利进入了美国、欧洲、澳洲、日本,实现了“专利出海”。

上海科技大学孵化企业“篆码生物”创办者——上科大季泉江教授
基因编辑热,热到什么程度?
众所周知,基因编辑是一个很热门的学科。不少遗传性疾病、致死率高的罕见病、慢性病,都希望通过基因编辑来治疗。
那么,基因编辑器的作用是什么?遗传性疾病有很多种机制导致,有的是因为基因突变,有的是因为基因缺失等,基因突变或缺失后,导致这种蛋白变成一种有害的蛋白或失去了原本的功能。“篆码生物”创办者——上科大物质学院季泉江教授解释,在治疗过程中,我们需要把有害蛋白的含量“敲低”,“敲低”的策略有好几种策略:基于底层核酸酶,用基因编辑核酸酶编码把这个有害蛋白的基因“打断”,在重新修复回去的过程中,会发生移码突变,有害基因就变为“不表达”,从而实现疾病的治疗。

季教授团队成员在做实验。 李蕾 摄影
除了做基因“敲除”,底层核酸酶还能做基因“插入”,后者应用的场景会更多。比如有的病人身体中某种特定的有益蛋白比较少或缺失,那就需要增补,需要通过基因编辑把原先的基因位点打断,把外来的有益基因“端”进去,实现基因的增补。
你追我赶,不轻言放弃
然而,这种神奇的基因剪刀——Cas9的核心专利都在美国,要想使用 ,要么向别人付费,要么拥有自己的基因编辑器。
更重要的是,传统CRISPR/Cas9系统在体内基因治疗领域存在分子尺寸大、递送难、脱靶多和免疫原性高等诸多限制。“早期,人们把CAS核酸酶分成两半,装成两个壳子来递送,但这样效率会变低。”因此,大家把研发的目光聚焦到“微型”基因编辑器上,因为核酸酶体积越小,越方便递送、方便接入,更容易实现“在体基因编辑”。
2016年,季泉江回国加入上海科技大学物质科学与技术学院,组建了化学生物学与基因编辑实验室,并开启了针对这一“卡脖子”难题的科研攻坚。2021年,团队在《自然-化学生物学》(Nature Chemical Biology)发文报道了微型基因编辑器—Cas12f,其分子尺寸仅为Cas9蛋白的三分之一,且能够在哺乳动物细胞中发挥有效的基因编辑功能。
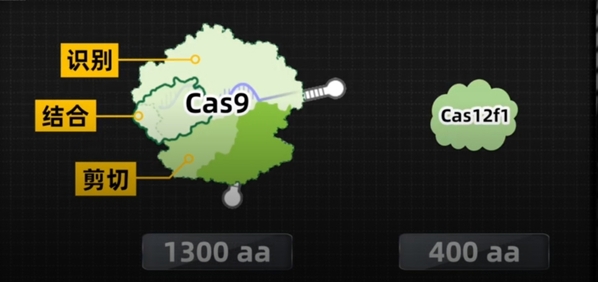
Cas12f与Cas9的大小比较。(来源:科普中国)
Cas12f的刊发,在国际上首次证明了微型基因编辑器具有哺乳动物细胞基因编辑活性。
然而,全球顶尖的王牌团队都把目光瞄准在微型基因编辑器的研发,竞争异常激烈。“在我们这个领域,最怕的就是,一觉醒来,刊物上别的研发团队发表了和你正在研究的一模一样的东西。” 果然,就在季泉江教授关于Cas12f科研成果刊发的同一天,韩国、美国的研发团队也发表了类似的科研成果。同样在2023年,季泉江团队关于Cas12f蛋白结构与工程的文章发表时,日本、美国的研发团队也发表了类似文章。
创新发现,只有第一,没有第二。由于韩国比我们早几个月率先申请了Cas12f的专利,并获得了融资。
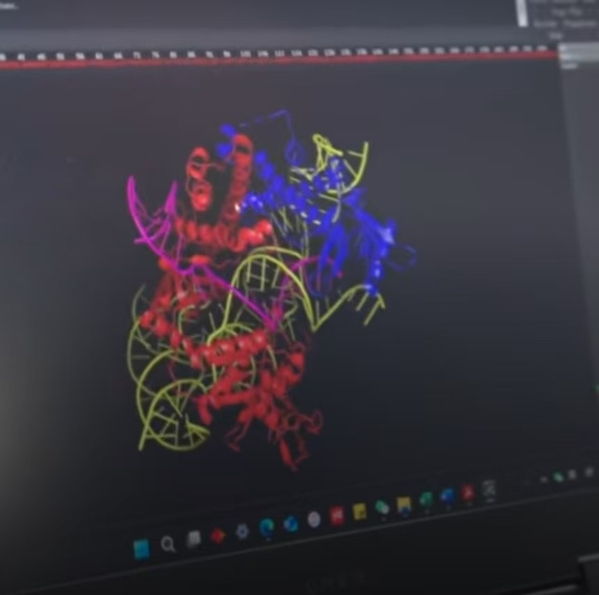
Cas12f的冷冻电镜分子结构图。
柳暗花明又一村
“你追我赶”之中,换个设计、思考路径,或许“柳暗花明又一村”。为了进一步获得真正具有完全自主知识产权的微型基因编辑器,季泉江带领团队朝着更具有原创性的基因编辑系统发起了挑战。
语速极快,是季教授留给记者最深的印象之一,这或许是长期习惯“争分夺秒”练就的。那一段时间,季教授整天对着电脑看公开的基因测序结构,究竟有没有一种更高效、更迷你的基因适合当编辑器?季教授一直在不断寻找、设计新的解决路径。
功夫不负有心人。2020年,受文献资料的启发,季教授发现Cas12n的结构、大小都十分符合理想的迷你基因编辑器。于是,季泉江带领团队用Cas12n做细菌实验,意外地发现它基因编辑工作得和Cas9一样好,大家都惊呆了——这么好用的东西,大家以前竟然没有去尝试证明。
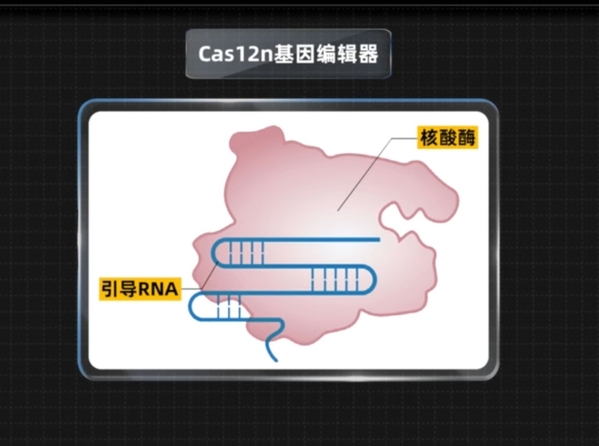
Cas12n基因编辑器主要构成部件。
原来,Cas核酸酶是基因编辑器的核心部件,而Cas12n的核酸酶主要来自细菌——一株来自中国南海海底海面上的微生物,是一类从未被研究过的微型核酸酶。季教授凭借经验,用肉眼把它从数据库中“挖”了出来。也正是因为这一核酸酶来源的稀缺性,免疫原性很低,能让更多的患者通过基因编辑进行治疗。
为何独具慧眼?与别的课题组不同的是,季教授的课题组早期是做微生物的,通过实验发现,在细菌中Cas12n完全可以胜任基因组编辑。“正因为有这样正向的结果使我们坚信,Cas12n的编辑功能是完整的。”季教授说,早期,大家对基因编辑还不是很了解,可能有许多盲目的尝试,后期机理研究清楚了,实现路径就变得更重要了。这一点,也是季教授在课堂上和学生们一直强调的,“多思考路径,有些东西即使重复多次也还是做不出来,因为方法、路径就错了。”

同学们送给季教授的教师节礼物,
两个模型中刻画的是Cas12f 和Cas12n的分子结构三维立体图。
从跟跑到领跑
发现Cas12n,并不容易。
“因为它隐藏得很深。”季泉江教授解释,一般来说,Cas核酸酶的引导RNA通常在核酸酶的非编码区,但是Cas12n的引导RNA却隐藏在核酸酶的编码区内部,通过序列比对、基因测序是无法发现的。“在此之前,从来没有一个引导RNA是在编码区的。”
在一次偶然的小RNA测序中,季教授团队发现在编码区内有一个RNA的富集区。于是,团队大胆猜测:这很可能就是引导RNA。果然,通过大量的实验证明了这一点。
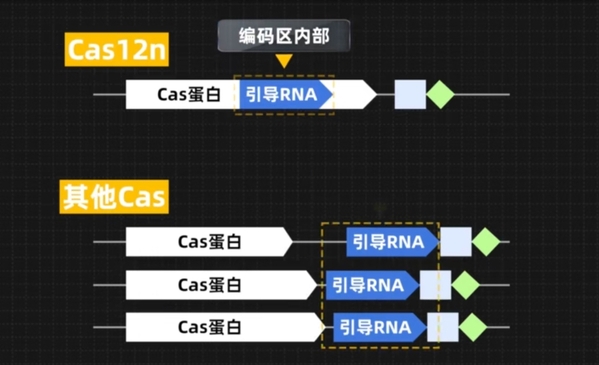
Cas12n的引导RNA隐藏在编码区中,很难被发现。
后面的道路也并非一帆风顺。“大约有两年的时间,我们在不断地实验,但是始终没有正向结果,在几乎要放弃的时候,我们终于捕捉到一个哺乳细胞样品有了效果。” 团队副研究员吴兆韡感叹,从0到1的过程往往是最痛苦、最漫长的,在不断尝试、不断失败中逐渐明晰未来的道路。
Cas12n的引导RNA非但隐蔽,而且很长。由此带来的问题是,通过化学合成引导RNA是比较困难的。因为,通常化学合成的极限在150nt(碱基长度单位),Cas12n引导RNA的长度在180-200nt左右,为此,后期季教授团队做了很多改善,把Cas12n的引导RNA缩短到130nt左右。
历经研究阶段的反复试错,2023年,季泉江团队在国际学术期刊《分子细胞》(Molecular Cell)上发表论文,首次报道了具有完全自主知识产权的高效精准微型基因编辑器——Cas12n,其创新型和应用前景都超过了Cas12f。从跟跑到领跑,填补了我国在基因编辑底层技术领域的空白,为开发基因编辑疗法提供了更高效、更易递送的工具。
全球共享研究路径
国际上有个平台——Addgene,这是一个分享科学的平台。季教授把有关Cas12n的工具、数据都放在这个平台上公开,如果有人需要即可直接在上面获取。“文章发表后,很多人来索要Cas12n。”有的是索要Cas12n的相关数据,有的是索要发现Cas12n的一套方法路径,来探索他们自己以前难以发现的东西。这种全新的研究路径,体现了这个科研成果更广泛的价值。
在上科大的帮助下,季教授团队找到了一家有经验的律所,完成了海内外的专利布局。目前,Cas12n的专利进入了美国、欧洲、澳洲、日本,实现了“专利出海”。“专利主要看第一个专利申请的日期,即优先权日期。有了Cas12f的经验,团队在2021年时就申请专利了,文章在2023年正式刊发前,一年之内团队补全了各种数据。

Cas12n的基因数据被索要超过100次,
Addgene平台给季教授颁发了“蓝色火焰”奖杯。
在学校和学院的支持下,季泉江与团队副研究员吴兆韡参加了上海科技大学创新创业大赛,受到了投资机构的关注。他们创立了上海科技大学孵化的初创企业——篆码生物(寓意“篆刻生命的密码”),成立之初便获得了来自幂方健康基金的独家数千万元种子轮融资。公司与上科大签署专利组合全球独占许可协议,开展产业应用转化。
目前,季教授团队对Cas12n的研究还在进行中。“要成为药物,还需要筛选各种靶点,因为即使同一个基因的不同的靶点,也有不同的编辑活性;同时还需要在各种动物模型中做测试。
站在Cas12n这一原创性突破的基石上,团队正加速绘制基因治疗的未来图谱。团队计划在未来建立基于微型基因编辑器的模块化治疗平台,将Cas12n与多种递送系统结合,开发出可编程的基因药物,用于治疗目前缺乏治疗方案的遗传性疾病和罕见病。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号