过氧化物酶体(peroxisome)是真核细胞中广泛分布的单层膜细胞器,在脂质代谢和活性氧清除等关键生物学过程中发挥重要作用,其功能异常与多种遗传性代谢病、癌症及神经退行性疾病的发生发展密切相关。
6月24日,上海科技大学生命科学与技术学院庄敏课题组在《自然-结构与分子生物学》(Nature Structural & Molecular Biology)上在线发表题为“PEX14 condensates recruit receptor and cargo pairs for peroxisomal protein import”的研究论文,揭示了PEX14蛋白通过形成生物凝聚体,高效招募被转运蛋白,并将其递送至过氧化物酶体转运孔道的分子机制。

过氧化物酶体功能的正常发挥依赖于将细胞质中合成的代谢酶精确转运至过氧化物酶体基质,使其在特定环境中执行催化任务。然而,过氧化物酶体的蛋白转运方式与其他细胞器(如内质网、线粒体、高尔基体等)截然不同,其独特之处在于能够将已完全折叠、具有完整三维结构的基质蛋白直接转运进入过氧化物酶体内部。长期以来,这种完整蛋白转运的分子机制一直是过氧化物酶体研究领域的重要“谜题”。
近年来,关于过氧化物酶体蛋白转运的机制研究不断获得新的突破。多项研究发现过氧化物酶体转运复合体亚基之一的PEX13能形成膜上的凝聚体通道,允许完整蛋白以类似穿过核孔复合物的方式通过此通道。但构成过氧化物酶体转运复合体的另一亚基PEX14的功能仍存在争议。
本研究采用多种生化方法结合结构预测,阐明了人源PEX14的分子组装和功能行使机制:PEX14通过其螺旋卷曲区域形成四聚体,而其C端结构域(CTD)依靠静电相互作用形成生物凝聚体且CTD的特定序列对过氧化物酶体蛋白转入至关重要。本研究还发现PEX14与PEX13能形成界限分明的“核-壳”型双相结构,进而提出了过氧化物酶体蛋白转运通道的不同亚基依次招募被转运蛋白以实现单向转运的工作模型。
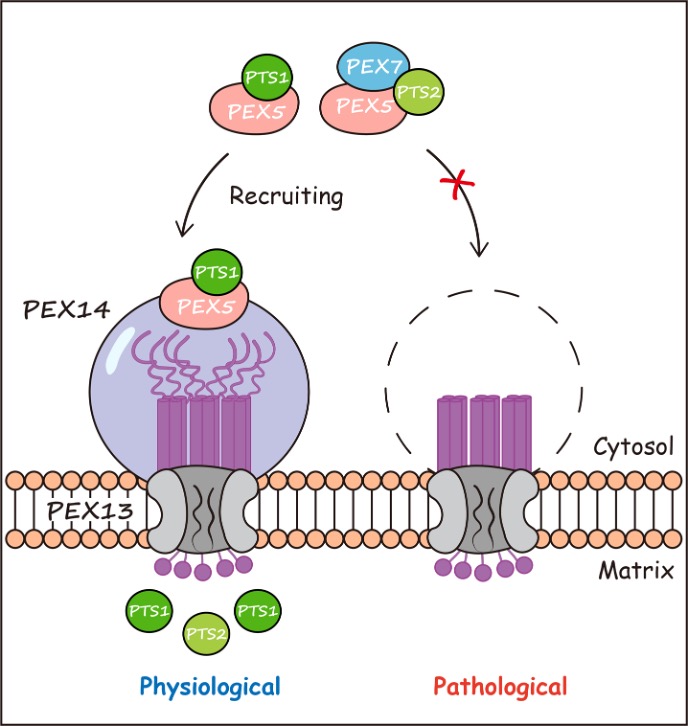
图. PEX14通过形成凝聚体招募被转运蛋白的示意图。
PEX14是过氧化物酶体转运复合物的核心组分,由于移码突变导致其CTD的遗传性缺失会引发Zellweger综合症等严重的致死疾病。该工作不仅加深了对过氧化物酶体蛋白转运机制的理解,也为相关遗传疾病的发病机制提供了新的理论依据。
庄敏课题组博士研究生吴建国为该论文的第一作者,庄敏教授为通讯作者,上海科技大学为第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号