7月7日,上海科技大学免疫化学研究所张贺桥/Roger Kornberg研究团队(结构生物化学课题组)在国际学术期刊《细胞》(Cell)在线发表了题为“Structures of the measles virus polymerase complex with non-nucleoside inhibitors and mechanism of inhibition”的研究论文,报道了非核苷类抑制剂抑制麻疹病毒(Measles virus)和尼帕病毒(Nipah virus)RNA聚合酶复合物活性的分子机制。

麻疹病毒属于非节段负链RNA病毒(nsNSV),基本传染数(R0)可达12-18,即平均一名感染者可传染12-18人。这一数字高于新冠病毒奥密克戎毒株的R0 (8-10)及已灭绝的天花病毒的R0 (5-7)。据世界卫生组织(WHO)统计,仅2022年和2023年,麻疹病毒感染就导致约13.6万和10.7万人死亡,其中许多为5岁以下儿童。尽管目前已经有上市的麻疹病毒疫苗,但研究表明约5%的两剂疫苗接种者无法产生有效抗体。鉴于其极强的传染性和庞大的感染人群基数,麻疹病毒依然是全球重要的健康威胁。
尼帕病毒同属副黏病毒科nsNSV。近年来亚洲地区尼帕病毒感染事件时有发生。尼帕病毒可通过动物或人与人传播,感染后可引发脑炎、肺炎等严重症状,致死率高达70%。目前针对尼帕病毒的疫苗和抗病毒药物尚处于研发阶段,还没有上市产品用于预防或治疗尼帕病毒感染。麻疹病毒和尼帕病毒基因组分别编码8和6种蛋白,其中由L和P蛋白构成的RNA依赖的RNA聚合酶复合物(L-P复合物)是抗病毒药物研发的关键靶点。少数几种非核苷类抑制剂(non-nucleoside inhibitor),如ERDRP-0519、AS-136A和GHP-88309能够抑制麻疹病毒聚合酶活性,但其作用机制尚不十分清楚。
免化所张贺桥/Roger Kornberg团队长期致力于真核生物及病毒基因转录调控研究,2024年12月曾在Science Advances报道尼帕病毒RNA聚合酶复合物的结构特征,这也是本研究的重要前期基础。
在最新工作中,研究团队利用单颗粒冷冻电镜重构技术解析了3.0 Å分辨率下的麻疹病毒L-P复合物apo状态结构,显示L蛋白与四聚化的P蛋白组装形成锥形的聚合酶复合物(图1A)。随后又分别解析了麻疹病毒L-P复合物结合非核苷类抑制剂ERDRP-0519和AS-136A的3.4和3.3 Å冷冻电镜结构(图1B,1C)。有意思的是,这两种抑制剂均结合在对于催化至关重要的“GDN环”附近的口袋中。结构对比显示非核苷类抑制剂采取了别构抑制的作用机制去抑制麻疹病毒聚合酶活性。ERDRP-0519及AS-136A均可引起麻疹病毒聚合酶“GDN环”的构象变化:使其由“GDN-in”构象向“GDN-out”构象发生转变(图1D)。该构象变化后续可能通过破坏镁离子-核苷酸的结合来抑制RNA合成过程。新揭示的非核苷类抑制剂结合口袋也有望被开发为新的抗麻疹病毒药物结合位点。
与团队此前报道的尼帕病毒L-P复合物apo状态结构比较推测,ERDRP-0519也可能结合并抑制尼帕病毒聚合酶活性。利用表面等离子共振技术和体外生物化学活性实验验证了ERDRP-0519对尼帕病毒聚合酶的结合和抑制活性。最终解析的3.0 Å分辨率下ERDRP-0519结合尼帕病毒L-P复合物的冷冻电镜结构显示(图1E),与麻疹病毒一样,尼帕病毒聚合酶“GDN环”附近的口袋同样可以被ERDRP-0519结合,“GDN”环同样会发生构象重排,从而抑制聚合酶活性。该工作为麻疹病毒及尼帕病毒抗病毒药物的理性设计提供了关键的结构基础。
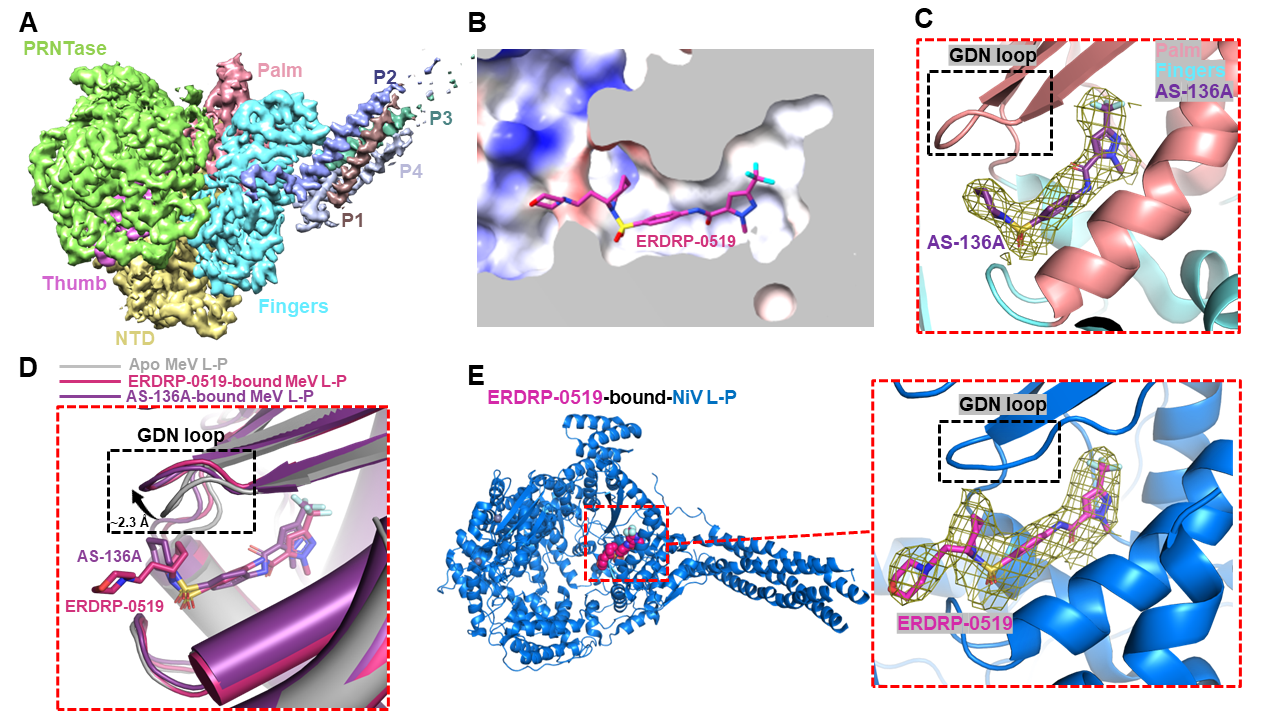
图1. 非核苷类抑制剂抑制麻疹病毒及尼帕病毒聚合酶的分子机制
(A) 麻疹病毒L-P复合物冷冻电镜重构图;(B) ERDRP-0519结合麻疹病毒L-P复合物的分子细节;(C) AS-136A结合麻疹病毒L-P复合物的分子细节;(D) 非核苷类抑制剂诱导麻疹病毒聚合酶发生构象变化;(E) ERDRP-0519结合尼帕病毒L-P复合物分子细节
免化所结构生物化学课题组2024级博士研究生王逸儒、高级工程师赵莉霞为本研究共同第一作者。结构生物化学课题组负责人张贺桥副研究员(Lead Contact)及Roger Kornberg特聘教授为共同通讯作者。上海科技大学为论文第一完成单位。其他作者包括免化所药物发现平台工程师张怡、分析化学平台高级工程师高秀霞、结构生物化学课题组高级工程师王雁南及2025级博士研究生史雯萍。论文在修回过程中得到了西湖大学柴继杰教授的指导和帮助。冷冻电镜数据收集工作在上海科技大学生物电镜平台完成。
论文链接:https://www.cell.com/cell/fulltext/S0092-8674(25)00683-X


 沪公网安备 31011502006855号
沪公网安备 31011502006855号