近日,上海科技大学生命科学与技术学院许文青课题组和合作者在国际学术期刊《美国科学院院报》(PNAS) 发表了题为“De novo design of protein binders to stabilize monomeric TDP-43 and inhibit its pathological aggregation”的研究论文,首次通过人工智能驱动的从头蛋白质设计技术,开发出可高亲和力特异性结合TDP-43 LCD聚集核心的新型结合剂,在体外和细胞模型中均实现了对TDP-43病理性聚集的高效抑制,为神经退行性疾病的靶向治疗提供了全新策略。

神经退行性疾病的发生发展与蛋白质错误折叠及病理性聚集密切相关,其中TDP-43(43 kDa反式激活反应DNA结合蛋白)的异常聚集是肌萎缩侧索硬化症(ALS)、额颞叶变性(FTLD)等疾病的核心病理特征——约97%的ALS患者和50%的FTLD患者脑组织中可检测到TDP-43的核内耗竭及胞质纤维化聚集物。这些聚集物不仅破坏RNA代谢稳态,更直接介导神经元毒性与疾病进展。由于TDP-43低复杂度结构域(LCD)属于内在无序区域(IDR),构象可变性极强,因此其聚集核心区域的靶向干预长期面临技术瓶颈,目前尚无有效小分子或生物大分子疗法获批。
TDP-43的生理功能依赖其结构化的N端结构域(NTD)和RNA识别基序(RRM1/2),而C端LCD是病理性聚集的主要驱动因子。LCD中,319-335残基在生理状态下呈α螺旋构象,而疾病状态下会发生“α螺旋→β折叠”的构象转变,进而组装成多形态纤维聚集体。本研究以“稳定TDP-43 CR区域α螺旋构象”为核心目标,搭建了从计算设计到功能验证的完整研究流程。借助扩散模型生成候选支架,经深度学习工具优化序列以增强与CR区域关键位点的相互作用,再通过能量筛选与结构预测,最终确定高潜力结合剂候选(图一)。
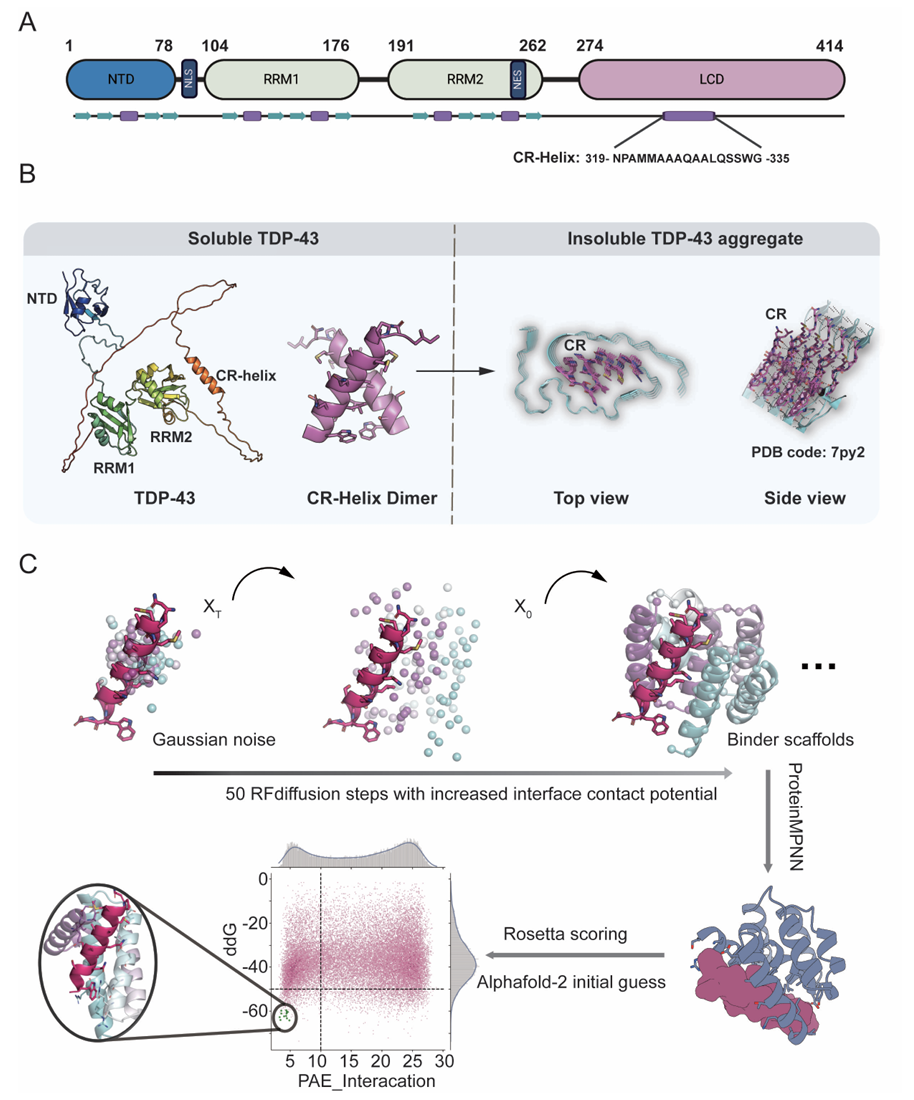
图一 本文工作流程图
在体外验证阶段,通过特异性检测β折叠聚集体的Tht实验与电镜观察,发现部分结合剂能有效抑制TDP-43聚集。通过结构预测发现该高效结合剂以特定结构与TDP-43 CR螺旋形成紧密疏水相互作用,后续核磁共振实验进一步证实其可特异性结合CR螺旋区域。最后在细胞层面,通过两种经典细胞模型验证了该结合剂能显著降低核内与胞质中TDP-43的聚集比例,并减少疾病相关标志物的水平(图二)。

图二 从头设计的结合蛋白对TDP-43纤维化聚集的抑制效果
本研究首次验证了通过稳定TDP-43内在无序区特定基序的α-螺旋构象来抑制其病理性聚集的可行性,为精准靶向神经退行性疾病的核心致病因子提供了新的思路。该策略还可能推广至其他神经退行性疾病中涉及淀粉样聚集的内在无序蛋白,例如阿尔茨海默病和帕金森病相关的致病蛋白。
上海科技大学生命科学与技术学院博士毕业生孙刚羽和上海交通大学博士生李想为本文共同第一作者。上海科技大学生命与技术学院许文青教授、王之礩副研究员,上海交通大学李丹教授,中国科学院上海有机化学研究所刘聪研究员为本文共同通讯作者。上海科技大学为第一完成单位和通讯单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号