近日,上海科技大学生命科学与技术学院孙博课题组在国际学术期刊《德国应用化学》(Angewandte Chemie International Edition)发表题为“Coexistence of G-Quadruplex and i-Motif Within a DNA Duplex is Tolerated by a PCBP2-Assisted Replisome”的研究论文,并被选为“Hot Paper”(热门论文)。该工作首次证实特殊DNA二级结构G-四链体(G-Quadruplex,G4)与i-Motif(iM)能够在同一条DNA双链中共存,同时揭示了致癌剪切因子PCBP2协助复制体克服这一复合结构障碍的新通路。

基因组DNA除经典的双螺旋构象外,还可形成多种非典型高级结构。其中,富含鸟嘌呤(G)或胞嘧啶(C)的序列可分别折叠形成G4和iM等二级结构。这些结构广泛分布在启动子、端粒等功能区域,密切参与转录调控、染色质重塑及基因组稳定性维护,因此成为相关疾病治疗的重要靶点。尽管G4与iM分别形成于互补的G富集链和C富集链,但受空间位阻限制,它们长期被认为难以在同一DNA双链区域内稳定共存。既往研究多依赖统计学预测或间接推断,缺乏证实二者“共存”或“互斥”的直接证据。这一认知局限不仅阻碍了研究人员对基因组结构异质性的深入理解,也无法阐明G4及iM对复制等关键DNA代谢过程的具体影响机制。
本工作综合运用单分子技术以及体外生化实验,直接证明了G4与iM可在同一DNA双链中形成稳定的共存结构,颠覆了传统的“互斥”假设。通过pH调控、小分子稳定剂干预以及单分子荧光及力学手段,系统刻画了iM:G4复合结构的形成条件、稳定性与转换特征,证明该复合结构在生理条件下具有高稳定性,能够长期存在,并对复制体构成不容忽视的结构性障碍(图1上)。在此基础上,研究进一步揭示了复制体跨越该复合障碍的蛋白辅助机制。致癌剪切因子PCBP2蛋白是一种与RNA剪接、mRNA稳定性及肿瘤发生密切相关的多功能核酸结合蛋白。研究发现,PCBP2对富C单链DNA具有高亲和力,并且能够显著削弱iM的稳定性;iM解折叠之后,共存的G4随之发生重塑,并与富C链退火形成双链DNA,从而为复制叉进展扫清障碍(图1下)。
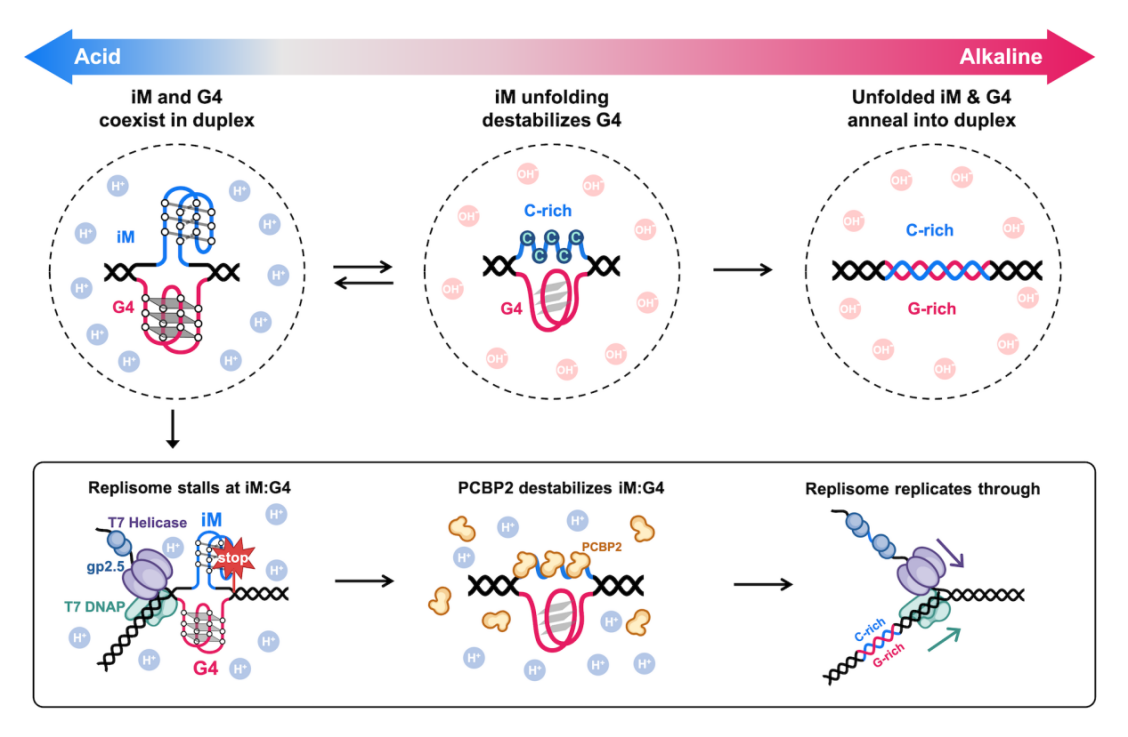
图1. iM:G4结构的动态变化及PCBP2介导的复制耐受机制。上图:微酸/中性pH下形成稳定iM:G4结构;碱性pH下iM:G4结构解折叠、退火恢复双链。下图:PCBP2通过特异性结合iM破坏iM:G4结构稳定性,消除其对T7复制体的阻滞作用。
该研究首次证明G4与iM可在双链DNA中稳定共存,揭示了PCBP2辅助DNA复制体跨越复杂二级结构障碍的新机制。这些发现不仅丰富了对基因组高阶结构和复制压力调控的认知,也为靶向PCBP2相互作用来干预肿瘤细胞复制压力提供了新的治疗思路。
上海科技大学生命科学与技术学院2023级博士研究生鲍彦伶及2025级博士研究生吴绍娟为论文共同第一作者,孙博副教授为通讯作者,上海科技大学为第一单位。
论文链接:https://doi.org/10.1002/anie.202523769


 沪公网安备 31011502006855号
沪公网安备 31011502006855号