细菌与噬菌体之间的共同演化通常表现为激烈的“军备竞赛”。例如,细菌通过CRISPR-Cas系统来抵御外来噬菌体入侵,而噬菌体则利用Anti-CRISPR蛋白来抑制这种免疫反应(图1)。那么在这场攻防博弈中,噬菌体是否会装备CRISPR-Cas系统,并“反向利用”细菌体内蛋白进行功能激活呢?这一可能性此前鲜有报道,机制亦不明确。
近日,上海科技大学物质科学与技术学院季泉江课题组在《自然-微生物学》(Nature Microbiology)发表了题为“Phage-associated Cas12p nucleases require binding to bacterial thioredoxin for activation and cleavage of target DNA”的研究论文,发现了一类噬菌体来源的新型超小型Cas12核酸酶——Cas12p(500-700个氨基酸),并揭示了其通过“劫持”细菌体内的硫氧还蛋白(TrxA)来激活自身DNA切割活性的独特分子机制(图1)。
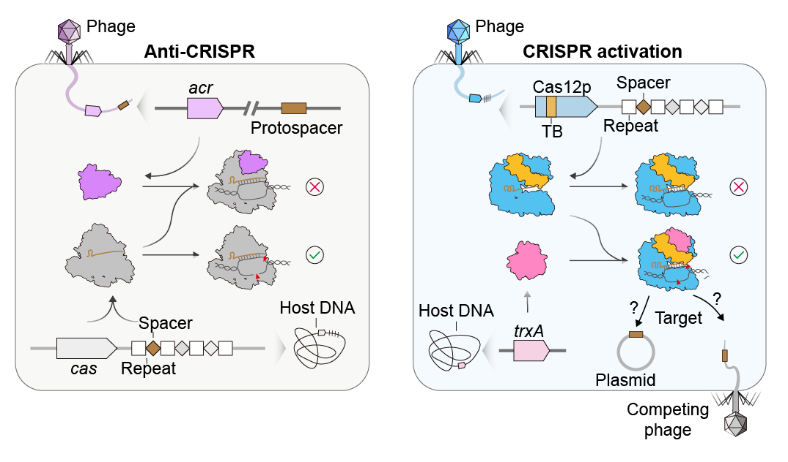
图1:Anti-CRISPR(左)与CRISPR activation(右)机制示意图
近年来,多种V型CRISPR-Cas12系统陆续被发现和表征,它们在蛋白结构、核酸靶向机制及生物学功能等方面呈现出丰富的多样性。研究团队推测自然界中仍蕴藏着大量未知变体,并据此建立了一套高效的V型CRISPR-Cas系统挖掘流程,从宏基因组数据中筛选出多种未被报道的候选Cas12蛋白(图2)。AlphaFold结构预测显示,Cas12p的识别(Recognition,REC)结构域存在一处内部无序区域,这一特征暗示其可能具备特殊功能。进化分析表明,Cas12p可能是转座相关蛋白TnpB向Cas12核酸酶进化的早期中间体。
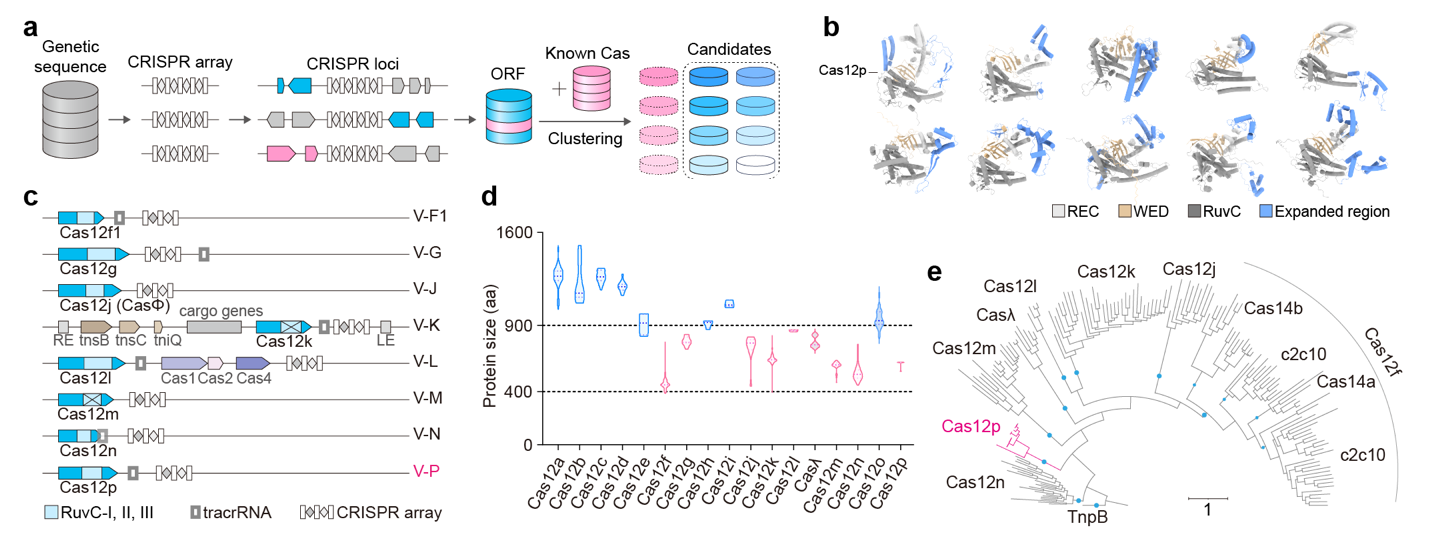
图2:CRISPR-Cas12系统的挖掘
a. 新型CRISPR-Cas12系统的生物信息学挖掘流程。b. 候选Cas12蛋白结构预测。 c. 微型CRISPR-Cas12系统的基因座结构。d. 不同Cas12蛋白的长度。e. TnpB蛋白与其他微型Cas12变体之间的进化关系树。
为了阐明Cas12p的作用机理,研究利用冷冻电镜技术解析了Cas12p复合物的高分辨率结构(图3),表明Cas12p与一个细菌内源性蛋白存在紧密的相互作用。生化实验和质谱分析进一步确证了TrxA是Cas12p的特异性结合伴侣。
机制研究阐明了TrxA激活Cas12p的分子基础:Cas12p利用其独特的TrxA结合(TrxA binding,TB)结构域,主要通过疏水相互作用与TrxA形成稳定的异源二聚体(图3)。TrxA的结合诱导了Cas12p发生变构,将原本灵活的TB.b环锁定在特定构象。这种空间上的精准限位使得TB.b环能通过静电相互作用识别sgRNA-DNA杂合双链,进而激活核酸酶的底物切割活性。细菌遗传学实验表明,敲除trxA基因会导致Cas12p丧失基因组干扰能力,而回补trxA则能完全恢复其活性(图3)。这一系列证据证实,TrxA是Cas12p发挥功能所必需的“激活开关”。
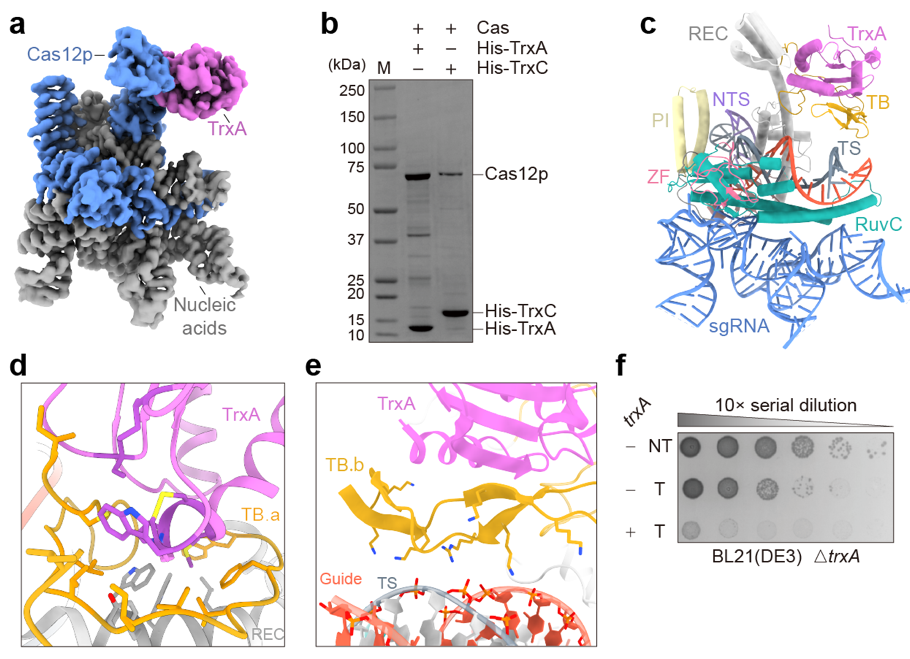
图3:TrxA激活Cas12p的分子机制
a. Cas12p 复合物冷冻电镜密度图。b. Cas12p与TrxA相互作用的生化验证。c. Cas12p-TrxA-sgRNA-dsDNA复合物的原子模型。d. Cas12p的TB结构域与TrxA的结合界面。e. Cas12p的TB结构域与sgRNA-DNA杂合双链之间的相互作用。f. trxA激活Cas12p的遗传回补验证。
Cas12p作为一种超小型核酸酶,其紧凑的尺寸降低了基因治疗的递送门槛。本研究揭示的“宿主因子辅助激活”机制为基因编辑工具的效率优化与活性调控提供了新方向:通过引入特定辅助因子和改造相关结构域,研究人员不仅有望提升其他超小型Cas蛋白的活性,还能利用对辅助因子的依赖性构建“分子开关”,实现对基因编辑的精准调控,从而开发兼具高活性与高安全性的基因编辑系统。
上海科技大学物质科学与技术学院季泉江课题组博士后王志鹏和王玉珏为该论文的共同第一作者,季泉江教授为通讯作者,上海科技大学为第一完成单位。
论文标题:Phage-associated Cas12p nucleases require binding to bacterial thioredoxin for activation and cleavage of target DNA


 沪公网安备 31011502006855号
沪公网安备 31011502006855号