T细胞能否有效“看见”肿瘤,往往决定肿瘤免疫治疗疗效的上限。T细胞依赖其表面的T细胞受体(TCR)识别肿瘤抗原肽-MHC复合物(pMHC),进而启动免疫应答并清除异常细胞。但在免疫选择压力下,肿瘤细胞常通过抗原突变、表达下调甚至缺失实现“隐身”,导致T细胞识别不足并发生免疫逃逸。因此,在不损害抗原特异性的前提下降低TCR触发阈值、提升其对抗原的敏感性,是扩充TCR候选库并增强TCR-T疗法疗效的关键问题。
近年研究表明,T细胞的活化水平与TCR和pMHC之间的亲和力并无相关性,而主要取决于二者在受力条件下的逆锁键(catch bond)水平。逆锁键是一种由氢键、盐桥等介导的非共价相互作用,在适当的机械力作用下,受体与配体能够获得更加持久的作用时长。中国科学院分子细胞科学卓越创新中心赵祥研究员前期依托逆锁键作用原理,针对特定空间距离的氨基酸残基开展文库设计以富集逆锁键,成功获得了低亲和力、高活化水平的TCR变体,同时有效规避了临床应用中的脱靶毒性风险。该策略依赖高分辨率结构信息,而多数天然TCR-pMHC复合物的亲和力水平较低、结构解析困难,使其应用范围受到了一定的限制。
围绕这一问题,2月19日,上海科技大学生命科学与技术学院孙博课题组与赵祥研究员等国内外研究团队在《细胞》(Cell)发表了题为“Tuning the sensitivity of mechanosensory receptors through histidine scanning”的研究论文。他们建立了一种基于组氨酸扫描的工程化改造策略,可显著增强TCR等力感应受体的活化效能。该工作不仅为理解力感应受体活化的机制奠定了基础,也为相关疾病的免疫治疗提供了新思路。

前期研究结果的系统分析显示,组氨酸在逆锁键改造成功的案例中出现频率最高、贡献最为突出。由于组氨酸的侧链基团可充分激发受体与配体的逆锁键相互作用,本研究将TCR互补决定区(CDR区)中的氨基酸残基逐一替换为组氨酸,筛选活化水平提高的组氨酸突变体。该方法无需借助TCR-pMHC的三维结构,仅仅依靠TCR的氨基酸序列,即可快速定位其中的改造热点,实现高效改造。
为验证该方法的通用性和有效性,本研究选取了十余种针对病毒抗原、公共新抗原、癌睾抗原、过表达抗原及分化抗原的人源和鼠源TCR,系统开展了组氨酸扫描改造实验。每种TCR中均能发现近10个激活水平显著提高的改造点,充分证明组氨酸扫描法是一种适用于多类型TCR的通用逆锁键改造策略。研究进一步在机制层面上解析了组氨酸增强逆锁键的分子基础。分子动力学模拟和单分子光镊实验发现,组氨酸优势突变体在受力条件下可与配体形成数量更多、寿命更长的逆锁键。从胞内信号传导角度看,逆锁键水平的提升促进了下游激酶的募集与磷酸化事件,从而放大了T细胞的活化信号。
为验证该方法的安全性,本研究还系统比较了野生型TCR和组氨酸突变体的抗原结合模式,并结合生物信息学方法预测潜在的交叉反应多肽。验证结果排除了组氨酸突变体在该范围内的脱靶毒性,表明组氨酸扫描法能够在增强TCR活化能力的同时,维持TCR的抗原特异性。在此基础上团队围绕前期鉴定的改造热点,构建了由极性、带电荷氨基酸组成的突变文库,获得了一系列亲和力较低、但激活水平更高的TCR变体。体外功能实验及动物实验表明,经改造后的TCR-T细胞在黑色素瘤、血液瘤、肠癌和骨肉瘤等多种动物模型中,均表现出更强的肿瘤识别与清除能力,充分验证了该方法潜在的临床应用价值。
值得注意的是,组氨酸扫描法的应用价值并不局限于TCR。研究发现,该方法在DLL4-Notch、Fc-FcγR等多种力感应配体-受体中均表现出良好的改造效果。通过增强受体-配体相互作用中的逆锁键水平,有效提高了这些力感应受体的敏感性。上述结果不仅为干细胞和发育生物学等研究领域提供了新的技术工具,也为抗体药物研发开辟了新的思路。
综上,本工作成功开发了一种安全、高效、通用的力感应受体工程改造方法,有效解决了现有技术依赖三维结构、适用范围有限的痛点,为TCR-T细胞疗法的优化升级提供了重要技术支撑,也为肿瘤免疫治疗、干细胞研究及抗体制药等多个领域的发展注入了新动力。
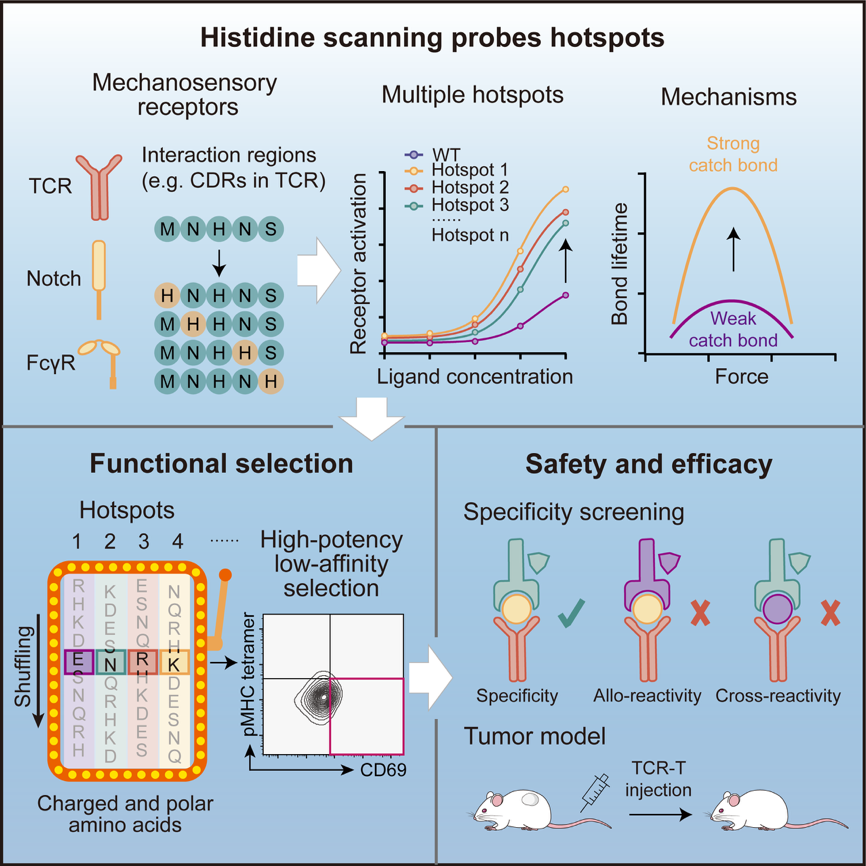
图:组氨酸扫描法对力感应受体的高质量赋能
中国科学院分子细胞科学卓越创新中心赵祥研究员、美国奥古斯塔大学佐治亚州免疫学中心Nicholas Gascoigne教授、中国科学院分子细胞科学卓越创新中心许琛琦研究员、上海科技大学生命学院孙博教授、辽宁师范大学化学与生物学交叉研究中心李国辉教授、中山大学肿瘤防治中心周鹏辉教授、美国东北大学冯寅年教授、新加坡国立大学吴凌博士为本文的共同通讯作者。中国科学院分子细胞卓越中心研究生王元昊、王俣涵、袁文杰、范鸣宇、博士后王晓静、辽宁师范大学化学与生物学交叉研究中心王安辉教授、上海科技大学生命学院博士生鲍彦伶、中山大学肿瘤防治中心博士后张亚静、新加坡国立大学Jia Chi Tan博士为本文的共同第一作者。
原文链接:https://www.cell.com/cell/abstract/S0092-8674(25)01499-0


 沪公网安备 31011502006855号
沪公网安备 31011502006855号